-
有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化.根据以上实验事实,判断这三种金属的活动性由强到弱的顺序为( )
A. Z Y X B. Y X Z C. X Y Z D. X Z Y
难度: 简单查看答案及解析
-
往AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。根据上述现象,你能得出的结论是 ( )
A.滤渣中一定有Fe粉 B.滤渣中一定有Cu粉
C.滤液中一定有Fe2+ D.滤液中一定有Ag+、Cu 2+
难度: 中等查看答案及解析
-
关于钢的说法不正确的是( )
A.钢是纯净物 B.钢是铁的合金
C.钢的含碳量低于生铁 D.钢的性能优于生铁
难度: 简单查看答案及解析
-
20 ℃时,取甲、乙、丙、丁四种纯净物各20 g,分别加入到四个各盛有50 g水的烧杯中,充分溶解,其溶解情况如下表:
物质
甲
乙
丙
丁
未溶解固体的质量 /g
4.2
2
0
9.2
下列说法正确的是( )
A.所得四杯溶液都是饱和溶液
B.丁溶液的溶质质量分数最大
C.20 ℃时四种物质溶解度的关系为:丙>丁>甲>乙
D.四杯溶液中溶液的质量大小为:丙溶液>乙溶液>甲溶液>丁溶液
难度: 简单查看答案及解析
-
芯片是电脑、“智能”加点的核心部件,它是用高纯度硅制成的.下面是生产单质硅过程中的一个重要反应:
,该反应的基本类型是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
难度: 简单查看答案及解析
-
“金银铜铁锡”俗称五金。在这五种金属中,有一种金属与其他四种金属的盐溶液都能 发生反应,这种金属是( )
A.金 B.铜 C.铁 D.锡
难度: 简单查看答案及解析
-
如图所示,是甲、乙、丙三种固体物质的溶解度曲线.下列说法正确的是( )
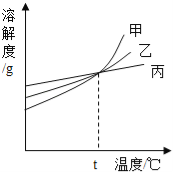
A. t℃时,甲、乙、丙三种物质的饱和溶液的质量分数相等
B. 在两份相同质量的水中分别加入甲与丙,达到饱和时溶解甲的质量大于丙
C. 相同温度时,甲、乙、丙三种饱和溶液,其质量分数关系为:甲>乙>丙
D. 甲中混有少量丙时,可采用高温制成热的饱和溶液,再蒸发结晶提纯甲
难度: 中等查看答案及解析
-
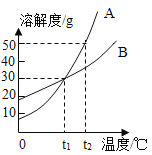
下图是A、B、C三种物质的溶解度曲线,下列分析不正确的是( )

A.50℃时A、B、C三种物质的溶解度由大到小的顺序是A>B>C
B. 50℃时把50gA放入50g水中能得到A的饱和溶液,其中溶质与溶剂的质量比为1:2
C.将C的饱和溶液变为不饱和溶液,采用降温额方法
D.将50℃时A、B、C三种物质的饱和溶液降温至20℃时,这三种溶液的溶质质量分数的大小关系是B>A=C
难度: 中等查看答案及解析
-
光亮的铁钉在下列几种情况下,最不容易生锈的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
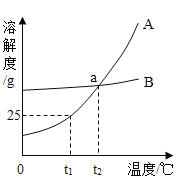
硝酸钾和氯化钠的溶解度曲线如右图所示。30℃时,分别将30g硝酸钾和氯化钠放入100 g水中,充分溶解。下列结论中,不正确的是

A.两种溶液中溶质的质量分数相等
B.通常情况下,采取降温的方法能将两种溶液都变成饱和溶液
C.若将硝酸钾溶液降温到20℃, 溶液中溶质和溶剂的质量比为3:10
D.若将硝酸钾溶液变为10℃时的饱和溶液, 溶液中溶质的质量分数一定减小
难度: 中等查看答案及解析