-
人体内的一些液体正常pH范围如下,其中呈酸性的是
A. 血浆7.35-7.45 B. 胆汁7.1-7.3
C. 胃液0.9-1.5 D. 胰液7.5-8.0
难度: 中等查看答案及解析
-
空气中体积分数约占78%的气体是
A.二氧化碳 B.氮气 C.氧气 D.稀有气体
难度: 极难查看答案及解析
-
下列人体所必须的元素中,青少年缺少会引起佝偻病的是
A.钙 B.铁 C.锌 D.碘
难度: 简单查看答案及解析
-
下列物质中,含有氧分子的是( )
A. 空气 B. MnO2 C. CO2 D. H2O2
难度: 简单查看答案及解析
-
下列金属活动性最强的是
A.锌 B.铝 C.铜 D.银
难度: 简单查看答案及解析
-
下列物质不能溶于水形成溶液的是
A.香油 B.蔗糖 C.食盐 D.味精
难度: 简单查看答案及解析
-
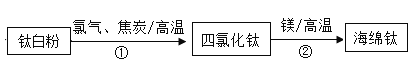
在“粗盐中难溶性杂质的去除”实验中,下列实验步骤的正确顺序是

A.①②③ B.②①③ C.③②① D.②③①
难度: 简单查看答案及解析
-
“依稀记得校园里的那株桂花树,一到花开时节,每个角落都能闻到它的香气”。每个角落都能闻到花香的原因是
A.分子的质量很小 B.分子间有间隔
C.分子由原子构成 D.分子在不断运动
难度: 简单查看答案及解析
-
屠呦呦因提取研究青蒿素(C15H22O5)用于治疗疟疾,而荣获2015年诺贝尔生理学或医学奖。下列有关青蒿素的说法不正确的是
A.它由碳、氢、氧三种元素组成
B.其分子中,碳、氧原子个数比为3:1
C.其中碳、氢、氧元素的质量比为15:22:5
D.其中碳元素的质量分数最大
难度: 简单查看答案及解析
-
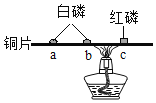
如图所示装置可用于测定空气中氧气的含量。下列说法不正确的是
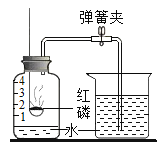
A.实验前一定要检查装置的气密性
B.红磷足量是实验成功的关键之一
C.该实验所用的红磷可用铁丝代替
D.待反应装置冷至室温打开弹簧夹
难度: 中等查看答案及解析
-
如下图是某反应前后分子种类变化的微观示意图。下列说法正确的是
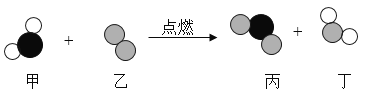

A.反应前后分子个数不变 B.反应中涉及到3种氧化物
C.反应中甲、乙分子个数比为1:1 D.丙的相对分子质量为64
难度: 简单查看答案及解析
-
已知:20℃时,KCl和KNO3的溶解度分别为34 g和31.6 g。配制20℃时的如下四种溶液:
溶液
①
②
③
④
固体种类
KCl
KCl
KNO3
KNO3
加入固体的质量/g
20
35
20
35
水的质量/g
100
100
100
100
下列有关溶液①~④的说法不正确的是
A.属于饱和溶液的是②④
B.溶液的质量②=④
C.溶液中溶质的质量分数①=③
D.②中溶质与溶剂的质量比为17:50
难度: 中等查看答案及解析