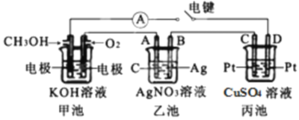
-
“舌尖上的安全”成为现代社会的头等大事之一。下列做法符合食品安全要求的是( )
A.用亚硝酸钠代替食盐烹调食物 B.用碳酸氢钠做发酵粉
C.用霉变油菜籽作食用油 D.工业酒精勾兑饮用白酒
难度: 中等查看答案及解析
-
下列有关化学用语使用正确的是
①甲基的电子式
②Cl-的结构示意图:
③乙烯的分子式:CH2=CH2
④中子数为20的氯原子:
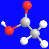
⑤乙酸分子的比例模型:
⑥氯乙烷的结构式
A.④ B.③④⑤ C.④⑤⑥ D.①③④⑤⑥
难度: 简单查看答案及解析
-
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A.a=b
B.混合溶液的PH=7
C.混合溶液中,c(H+)=
mol.L-1
D.混合溶液中c(H+)+c(B+)=c(OH-)+C(A-)
难度: 中等查看答案及解析
-
下列指定溶液中一定能大量共存的离子组是
A.pH=1的无色溶液中:NH
、Na+、Fe3+、
B.含有大量Ba2+的溶液中:Na+、K+、HCO
、NO
C.中性溶液中:K+、Fe3+、Cl-、
D.Na2S溶液中:
、K+、Fe3+、Cl-
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。则下列说法不正确的是
X
Y
W
Z
A.原子半径大小:Y<X
B.X的简单气态氢化物比W的稳定
C.Z的最高价氧化物对应的水化物是一种强酸
D.W的单质常用制光导纤维
难度: 中等查看答案及解析
-
工业上可由下列方法制得高效饮用水处理剂高铁酸钠(Na2FeO4):Fe2O3+3Na2O2
2Na2FeO4+Na2O,下列说法正确的是( )
A.Fe2O3可以通过铁丝在氧气中燃烧制得
B.反应中Fe2O3是还原剂
C.3molNa2O2反应,有3mol电子转移
D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌
难度: 中等查看答案及解析
-
下列说法能用平衡移动原理解释的是
A.在电解水实验中,加入硫酸钠可以提高电解效率
B.碳酸氢钠溶液与硫酸铝溶液混合有沉淀和气体生成
C.在一定温度下某容器内发生下列反应:I2(g)+H2(g)
2HI(g) △H<0,缩小容器的体积,混合气体颜色加深
D.在双氧水中加FeCl3溶液可使产生O2速率加快
难度: 中等查看答案及解析
-
下列有关化学反应的表述正确的是
A.电解熔融NaCl:2Cl-+2H2O
2OH-+Cl2↑+H2↑
B.NaHS溶液显碱性:HS-+H2O
H3O++S2-
C.明矾净水:Al3++3H2O=Al(OH)3↓+3H+
D.制备TiO2纳米粉:TiCl4+(x+2)H2O(过量) = TiO2·xH2O↓+4HCl
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.构成原电池的两个电极必须是活泼性不同的两种金属
B.下图原电池中,电流由锌棒经外电路流向铜棒
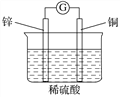
C.通过构成原电池,能将反应的化学能全部转化为电能
D.银锌纽扣电池的放电反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应
难度: 简单查看答案及解析
-
下列说法正确的是(NA表示阿伏伽德罗常数)
A.反应TiO2(s) + 2Cl2(g)=TiCl4(g) + O2(g) ΔH>0能自发进行,其原因是ΔS>0
B.地下钢铁管道用导线连接锡块可以减缓管道的腐蚀
C.除去MgCl2溶液中的少量FeCl3,加入足量氢氧化钠,充分反应后,过滤
D.1molCl2溶于水后,溶液中Cl2、HClO、ClO-、Cl-四种粒子总数为2NA
难度: 中等查看答案及解析
-
下列实验操作、现象与结论对应关系正确的是
选项
实验操作
实验现象
结论
A
向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1H2SO4溶液
试管口出现红棕色气体
溶液中NO
被Fe2+还原为NO2
B
向2 mL 1 mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液
先出现白色沉淀后又生成红褐色沉淀
证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀
C
在滴有酚酞的Na2CO3溶液中,
加入BaC12
溶液红色褪去
CO32-在溶液中存在水解平衡
D
常温下,测定盐酸和醋酸溶液的pH
盐酸pH小于醋酸pH
证明相同条件下,在水中HCl电离程度大于CH3COOH
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
下列与金属腐蚀有关的说法,正确的是
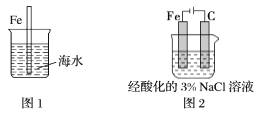

A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图2中,插入溶液中的铁棒容易溶解,主要是发生电化学腐蚀
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生电化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的负极
难度: 中等查看答案及解析
-
萘、四氢萘、十氢萘用途广泛,其转化关系为:
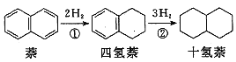 ,该过程中能量变化如图所示,下列说法不正确的是:
,该过程中能量变化如图所示,下列说法不正确的是: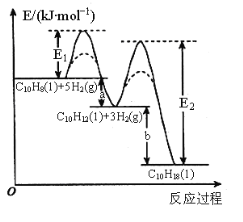
A.萘分子(
)的一氯代物有2种
B.实线表示无催化剂的反应过程,虚线表示有催化剂的反应过程
C.E1、E2表示活化能,a的大小由E1决定,b的大小由E2决定
D.物质的稳定性:十氢萘>四氢萘>萘
难度: 简单查看答案及解析