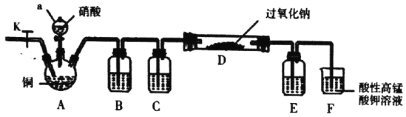
-
水是地球生命存在的基础,下列有关生活中水的说法不正确的是
A.海水淡化是大幅降低水中离子浓度的过程
B.ClO2是饮用水生产过程中高效安全的灭菌消毒剂
C.用K2FeO4处理水,既能杀菌消毒又可除去水中悬浮杂质
D.矿泉水富含人体必需的营养物质
难度: 简单查看答案及解析
-
《本草纲目》卷七石碱条:“彼人采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面”.则下列说法正确的是
A.文中的“灰”,指的是草木灰(主要成分K2CO3) B.“发面”是利用了“灰”的不稳定性
C.“以水淋汁,久则凝淀如石”的过程是萃取 D.该物质用来浣衣、去垢的过程涉及氧化还原反应
难度: 中等查看答案及解析
-
下列有关化学用语描述正确的是
A.二氧化硅的分子式:SiO2 B.C2H4O2是乙酸的结构简式
C.氯化铵的电子式:
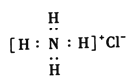 D.C3H6不一定是丙烯分子
D.C3H6不一定是丙烯分子难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值,下列说法不正确的是
A.17gH2O2中含有非极性健的数目为NA
B.标准状况下,1.12L16O2和1.12L18O2均含有0.1NA个氧原子
C.将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中铵根离子数目为NA
D.0.1mol甲烷和乙烯组成的混合气体完全燃烧,生成的水分子数为0.2NA
难度: 中等查看答案及解析
-
下列离子一定能大量共存的是
A.水溶液中:K+、Al3+、HCO3-、SO42-
B.酸性溶液中:Fe3+、Mg2+、I-、SO42-
C.澄清透明溶液:Cu2+、Na+、SO42-、NO3-
D.常温下水电离出的c(H+)=10-11 mol/L的溶液:K+、Na+、SiO32-、NO3-
难度: 中等查看答案及解析
-
下列操作能证明HF是弱电解质的是
A.用氢氟酸在玻璃上刻字
B.用氢氟酸做导电性试验,灯泡很暗
C.在0.1mol/L的HF溶液中加水,测得c(OH-)增大
D.在10ml pH=2的HF溶液中加入10m 0.01mol/L NaOH溶液,混合溶液呈酸性
难度: 简单查看答案及解析
-
下列实验装置及相应操作正确的是
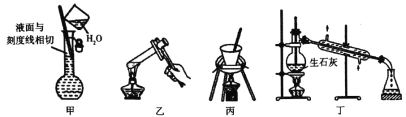
A.图甲可用于配制250ml 0.100mo1/L硫酸溶液时定容操作
B.图乙可用于淀粉在稀硫酸作用下发生水解后,直接滴加新制氢氧化铜悬浊液检验水解产物
C.图丙可用于胆矾结晶水含量测定
D.图丁可用于由工业乙醇制备无水乙醇
难度: 中等查看答案及解析
-
下列离子方程式能用来解释相应实验现象的是
A.铁粉溶于足量稀硝酸3Fe+8H++2NO3—=3Fe2++2NO↑+4H2O
B.三氯化铁溶液中滴入硫氯酸钾溶液出现血红色Fe3++3SCN—=Fe(SCN)3
C.饱和氯化铁溶液滴入沸水溶液呈现红褐色Fe3++3H2O=Fe(OH)3↓+3H+
D.四羟基合铝酸钠溶液与碳酸氢钠溶液混合产生白色沉淀 [Al(OH)4]—+ HCO3—=Al(OH)3↓+CO2↑+H2O
难度: 中等查看答案及解析
-
羟基香豆素(
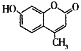 )是一种治疗胆结石的药物,下列关于该物质的叙述错误的是
)是一种治疗胆结石的药物,下列关于该物质的叙述错误的是A.该物质的分子式为C10H8O3
B.该物质氢核磁共振谱图上显示有5组峰
C.该物质分子中不可能所有原子共平面
D.该物质可以发生氧化反应、取代反应、加成反应等
难度: 中等查看答案及解析
-
已知几种物质之间的能量关系如图所示, 下列说法中正确的是
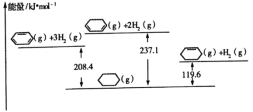
A.使用合适催化剂,能减小反应的焓变
B.
+H2(g)
(g) ΔH=+28.7kJ/mol
C.
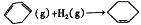 (g)中,热能转化为产物内部的能量
(g)中,热能转化为产物内部的能量D.
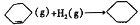 (g),反应物的总能量低于生成物的总能量
(g),反应物的总能量低于生成物的总能量难度: 中等查看答案及解析
-
某研究小组在探究电化学原理时,如图将盐桥换成n型弯铁丝,当接通直流电源后,石墨①附近溶液变红.下列判断或预测错误的是
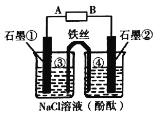
A.A为电源的负极
B.铁丝左端③附近出现灰绿色沉淀
C.电子移动方向为:A→石墨①→铁丝→石墨②→B
D.石墨棒②电极反应式为2Cl—-2e—=Cl2↑
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z原子序数依次增大,甲、乙、丙、丁、戊、己是由这些元素构成的物质。常温下,丙和戊是单质气体,乙为生活中常见的无色液体,戊能使带火星的木条复燃,0.01mol/L丁溶液pH=12,上述物质的转化关系如图所示.下面说法正确的是
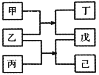
A.原子半径:X<Y<Z B.单质沸点:W>X
C.气态氢化物的热稳定性:X>Y D.Y和Z形成的化合物溶于水显碱性
难度: 中等查看答案及解析
-
以铝土矿(主要成分为Al2O3,还含少量Fe2O3、SiO2等)为主要原料生产金属铝的工艺流程如图:下列说法错误的是

A.碱溶过程发生复杂的氧化还原反应
B.过滤1的滤渣中含Fe2O3、SiO2等
C.X主要溶质是Na2CO3
D.产生Al和O2的电解过程通常使用助熔剂Na3AlF6
难度: 中等查看答案及解析
-
NaH2PO2为正盐,能将溶液中的Ag+还原为Ag,可用于化学镀银。利用NaH2PO2进行化镀银反应中,若氧化剂与还原剂的物质的量之比为4:1。下列说法正确的是
A.上述反应中,氧化产物是H3PO4
B.H3PO2是三元酸,与NaOH反应可生成三种盐
C.NaH2PO2中含有离子键、极性共价键和非极性共价键
D.该反应的离子方程式为H2PO2—+4Ag++2H2O=4Ag↓+PO43—+6H+
难度: 中等查看答案及解析
-
25℃时,将 CH3COOH和CH3COONa共0.1配制成1L溶液,溶液中CH3COOH和CH3COO—各自所占的物质的量分数(a)随溶液pH变化的关系如图所示。下列说法不正确的是
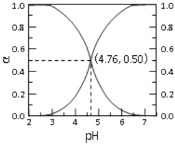
A.25℃时, CH3COO—的水解平衡常数为10—9.24
B.pH=4.76时,加入的CH3COOH和CH3COONa物质的量相等
C.pH<4.76时,一定有c(CH3COO—)+c(OH—)>c(H+)
D.4.76<pH<7时,c(CH3COO—)>c( Na+)>c(H+)>c(OH—)
难度: 中等查看答案及解析
-
在1L的密闭容器中充入2mol N2和7mol H2,发生反应N2+3H2=2NH3,保持其他条件不变,相同时间内测得NH3的浓度与温度的关系如图所示.下列叙述不正确的是
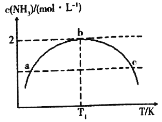
A.该反应是放热反应
B.a、c两点对应的压强 Pa<Pc
C.温度为T1时,N2的平衡转化率为50%
D.温度为T1时,再加入1mol N2和1mol NH3,平衡向正反应方向移动
难度: 中等查看答案及解析
 ,写出由XmYn聚合生成的高分子化合物的结构简式________。
,写出由XmYn聚合生成的高分子化合物的结构简式________。