-
室温下,有两种溶液:①0.01 mol·L-1 NH3·H2O溶液 ②0.01 mol·L-1 NH4Cl溶液,下列操作可以使两种溶液中c(NH4+)都增大的是( )
A.加入少量H2O B.加入少量NaOH固体
C.通入少量HCl气体 D.升高温度
难度: 简单查看答案及解析
-
W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是
A. X与其他三种元素均可形成两种或两种以上的二元化合物
B. Y与其他三种元素分别形成的化合物中只含有离子键
C. 四种元素的简单离子具有相同的电子层结构
D. W的氧化物对应的水化物均为强酸
难度: 中等查看答案及解析
-
室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色
X溶液中一定含有Fe2+
B
向浓度均为0.05 mol·L−1的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成
Ksp(AgI)> Ksp(AgCl)
C
向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色
Br2的氧化性比I2的强
D
用pH试纸测得:CH3COONa溶液的pH约为
9,NaNO2溶液的pH约为8
HNO2电离出H+的能力比CH3COOH的强
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol·L-1 NaOH溶液:Na+、K+、CO32-、AlO2-
B.0.1 mol·L-1 FeCl2溶液:K+、Mg2+、SO42-、MnO4-
C.0.1 mol·L-1 K2CO3溶液:Na+、Ba2+、Cl-、OH-
D.0.1 mol·L-1 H2SO4溶液:K+、NH4+、NO3-、HSO3-
难度: 简单查看答案及解析
-
《厉害了,我的国》展示了中国五年来探索太空,开发深海,建设世界第一流的高铁、桥梁、码头,5G技术联通世界等取得的举世瞩目的成就。它们与化学有着密切联系。下列说法正确的是
A.为打造生态文明建设,我国近年来大力发展核电、光电、风电、水电,电能属一次能源
B.大飞机C919采用大量先进复合材料、铝锂合金等,铝锂合金属于金属材料
C.我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅
D.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
难度: 中等查看答案及解析
-
下列与化学有关的说法正确的是( )
A.铝的钝化、煤的气化、漂白粉杀菌消毒过程中均有化学反应发生
B.碳酸钠可用于治疗胃酸过多症
C.浓硫酸可刻蚀石英制艺术品
D.氢氧化铁胶体、淀粉溶液、NaCl溶液均具有丁达尔效应
难度: 简单查看答案及解析
-
对甲基苯乙烯(
)是有机合成的重要原料。下列对其结构与性质的推断错误的是( )
A. 分子式为
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种
不考虑立体异构
D. 分子中所有原子可能处于同一平面
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 室温下用稀NaOH溶液吸收Cl2:Cl2+2OH−
ClO−+Cl−+H2O
B. 用铝粉和NaOH溶液反应制取少量H2:Al+2OH−
+H2↑
C. 室温下用稀HNO3溶解铜:Cu+2
+2H+
Cu2++2NO2↑+H2O
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+
H2SiO3↓+2Na+
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述不正确的是( )
A.相同质量的CO和N2,所含原子个数相同
B.pH=1的H3PO4溶液中,含有0.1NA个H+
C.标准状况下,11.2L甲烷和乙烯混合物中含极性键数目为2NA
D.足量锌与一定量浓H2SO4反应,生成1 mol气体时转移的电子数目为2NA
难度: 中等查看答案及解析
-
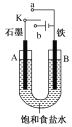
电化学气敏传感器可用于监测环境中NH3的含量,其中工作原理如图所示。则下列说法正确的是

A. 电流由a极流向b极
B. 溶液中的OH﹣向b极移动
C. a极的电极反应式为:2NH3﹣6e﹣═N2+6H+
D. b极的电极反应式为:O2+4e﹣+2H2O═4OH﹣
难度: 中等查看答案及解析
-
将4 mol A气体和2 mol B气体在2 L的定容密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)
2C(g);经2 s后测得C的物质的量浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的这段时间的平均速率为0.3 mol·L-1·s-1
②用物质B表示的这段时间的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为30%
④2 s时物质B的物质的量浓度为0.3 mol·L-1
其中正确的是( )
A. ①③ B. ②④ C. ①② D. ③④
难度: 简单查看答案及解析
-
对于下图所示实验,下列实验现象预测或操作正确的是
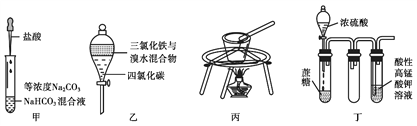
A. 实验甲:匀速逐滴滴加盐酸时,试管中没气泡产生和有气泡产生的时间段相同
B. 实验乙:充分振荡后静置,下层溶液为橙红色,上层为无色
C. 实验丙:由MgCl2•6H2O制备无水MgCl2
D. 装置丁:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
难度: 中等查看答案及解析
-
室温下,用0.100mol•L﹣1的NaOH溶液分别滴定体积和浓度均为20.00mL 0.100mol•L﹣1的盐酸和醋酸滴定曲线如图所示。下列说法错误的是( )
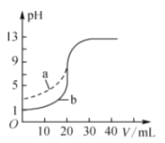
A.a表示的是醋酸的滴定曲线
B.滴定b过程中,指示剂可以是酚酞
C.pH=7时,滴定盐酸消耗的V(NaOH)=20.00mL
D.V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
难度: 中等查看答案及解析
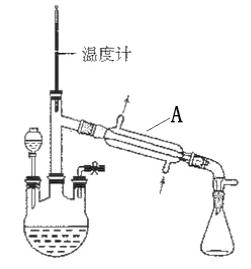
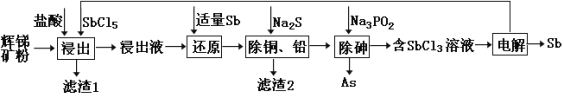
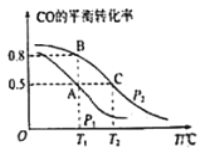 前景。
前景。