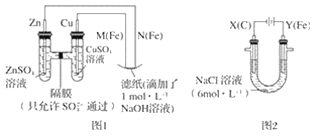
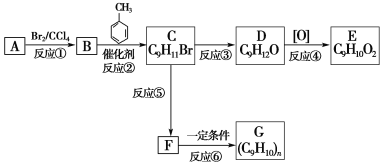
-
国家游泳中心(俗称“水立方”)采用了高分子膜材料“ETFE”,该材料是四氟乙烯(CF2=CF2)与乙烯(CH2=CH2)发生聚合反应得到的高分子材料,下列说法不正确的是( )
A. “ETFE”分子中可能存在“﹣CH2﹣CH2﹣CF2﹣CF2﹣”的连接方式
B. 合成“ETFE”的反应为加聚反应
C. CF2=CF2和CH2=CH2均是平面形分子
D. CF2=CF2可由CH3CH3与F2两种物质直接反应制得
难度: 中等查看答案及解析
-
下列变化不能用勒夏特列原理解释的是
A.合成氨是放热反应,采用在较高温度下进行反应
B.氯化镁溶液加热蒸干最终得不到氯化镁固体
C.工业生产硫酸的过程中使用过量的空气,以提高二氧化硫的转化率
D.实验室用排饱和食盐水的方法收集氯气
难度: 中等查看答案及解析
-
以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背发展低碳经济的是
A.发展氢能和太阳能
B.限制塑料制品的使用
C.提高原子利用率,发展绿色化学
D.尽量用纯液态有机物代替水作溶剂
难度: 简单查看答案及解析
-
下列操作会促进H2O的电离,且使溶液pH>7的是
A.将纯水加热到90 ℃ B.向水中加少量NaOH溶液
C.向水中加少量Na2CO3溶液 D.向水中加少量FeCl3溶液
难度: 中等查看答案及解析
-
一定温度下,向一个一定容积的密闭容器中放入3 mol X和2 mol Y,发生反应:X(g)+Y(g)
2Z(g)+R(g),达平衡时X的转化率为φ1。维持温度不变,若把6 mol X和3 mol Y放入该容器中,达平衡时X的转化率为φ2,则φ1与φ2的关系是( )
A.φ1>φ2 B.φ1<φ2 C.φ1=φ2 D.无法判断
难度: 困难查看答案及解析
-
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是
A.分子式为C7H6O5
B.分子中含有2种官能团
C.可发生加成和取代反应
D.在水溶液羧基和羟基均能电离出H+
难度: 中等查看答案及解析
-
下列为制取溴苯实验的有关现象的叙述和解释,其中正确的是( )
A.实验室制取的溴苯的实验后液体呈褐色,由于产物溴苯是褐色的
B.溴苯比水轻,因此溴苯浮在水面上
C.实验室制取溴苯时,导管口出现白雾,是由于HBr遇水蒸气而形成的
D.溴苯和苯的混合物可以用水萃取分离
难度: 简单查看答案及解析
-
在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)
2SO3(g) ΔH<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
A.图
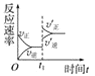 表示的是t1时刻增大O2的浓度对反应速率的影响
表示的是t1时刻增大O2的浓度对反应速率的影响B.图
 表示的是t1时刻加入催化剂对反应速率的影响
表示的是t1时刻加入催化剂对反应速率的影响C.图
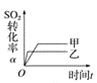 表示的是催化剂对平衡的影响,且甲的催化剂效率比乙高
表示的是催化剂对平衡的影响,且甲的催化剂效率比乙高D.图
 表示的是压强对化学平衡的影响,且乙的压强较高
表示的是压强对化学平衡的影响,且乙的压强较高难度: 中等查看答案及解析
-
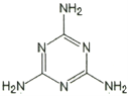
一种新型锅炉水添加剂的分子结构如图所示,该添加剂能除去锅炉水中溶解的氧气。下列有关说法正确的是( )

A.该添加剂与尿素[CO(NH2)2]互为同系物
B.分子中各原子的最外层均达到八电子稳定结构
C.分子中所有原子共平面
D.该添加剂具有还原性
难度: 简单查看答案及解析
-
已知反应:X+3Y
2Z,建立平衡后改变条件Z的百分含量变化如图,则判断正确的是 ( )
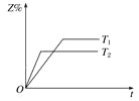
A. ΔH>0 B. ΔH<0 C. ΔH=0 D. 无法判断
难度: 中等查看答案及解析
-
常温下c(OH-)最小的是 ( )
A.pH=0的溶液. B.0.05 mol·L-1H2SO4
C.0.5 mol·L-1HCl D.0.05 mol·L-1的Ba(OH)2
难度: 简单查看答案及解析
-
苯在催化剂存在下与液溴反应,而苯酚与溴水反应不用加热也不需催化剂,原因是( )
A. 苯环与羟基相互影响,使苯环上氢原子活泼
B. 苯环与羟基相互影响,使羟基上氢原子变活泼
C. 羟基影响了苯环,使苯环上的氢原子变活泼
D. 苯环影响羟基,使羟基上的氢原子变活泼
难度: 中等查看答案及解析
-
某实验小组学生用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应、通过测定反应过程中所放出的热量计算反应热。下列说法正确的是

A.如图条件下实验过程中没有热量损失
B.若改用60mL0.50mol/L盐酸跟50mL0.55mol/L的NaOH溶液进行反应,通过测定反应过程中所放出的热量相等
C.图中实验装置缺少环形玻璃搅拌棒
D.烧杯间填满碎纸条的作用是固定小烧杯。
难度: 简单查看答案及解析
-
已知反应:H2S(g)+aO2(g)===X+cH2O(l) ΔH,若ΔH表示该反应的燃烧热,则X为( )
A.S(s) B.SO2(g) C.SO3(g) D.SO3(l)
难度: 简单查看答案及解析
-
取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。则下列说法错误的是( )
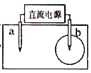
A.b电极是阴极 B.a电极与电源的正极相连
C.电解过程中水是氧化剂 D.b电极附近溶液的pH变小
难度: 中等查看答案及解析
-
下列有关有机物分离提纯的方法正确的是
A.溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出I2
B.乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷
C.除去乙醇中的微量水可加入金属钠,使其完全反应
D.乙烯中混有CO2和SO2,将其通过盛有NaOH溶液的洗气瓶,再干燥
难度: 中等查看答案及解析
-
下列反应中不属于可逆反应的是( )
A.Pb+PbO2+2H2SO4
2PbSO4+2H2O
B.N2+3H2
2NH3
C.Cl2+H2O
HCl+HClO
D.2NO2
N2O4
难度: 简单查看答案及解析
-
已知氢气、乙烷、甲醇、甲烷的燃烧热分别为285.8 kJ·mol-1、1 559.8 kJ·mol-1、726.51 kJ·mol-1、890.31 kJ·mol-1,相同质量的氢气、乙烷、甲醇、甲烷完全燃烧时,放出热量最多的是( )
A.H2(g) B.C2H6(g) C.CH3OH(l) D.CH4(g)
难度: 中等查看答案及解析
-
下列关于电解池的说法正确的是
A.电源的负极就是阴极
B.与直流电源正极相连的是电解池的阴极
C.与直流电源负极相连的电极上发生还原反应
D.阳极上发生还原反应
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.25 ℃时,向饱和AgCl水溶液中加入盐酸,Ksp变小
B.25 ℃时,向CaCO3饱和溶液通入CO2,有沉淀生成
C.25 ℃时,向CaCl2溶液中通入CO2,有白色沉淀生成
D.25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl溶液,c(Mg2+)增大
难度: 中等查看答案及解析
-
X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
A. 33% B. 40% C. 50% D. 65%
难度: 中等查看答案及解析
-
如图中C%表示某反应物在体系中的百分含量,v表示反应速率,p表示压强,t表示反应时间。图(A)为温度一定时,压强与反应速率的关系曲线;图(B)为压强一定时,在不同时间C%与温度的关系曲线。同时符合以下两个图像的反应是( )
A
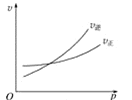 B
B 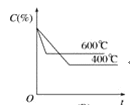
A.4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH<0
B.N2O3(g)
NO2(g)+NO(g) ΔH>0
C.3NO2(g)+H2O(l)
2HNO3(l)+NO(g) ΔH<0
D.CO2(g)+C(s)
2CO(g) ΔH>0
难度: 中等查看答案及解析
-
在可逆反应中,改变下列条件一定能加快反应速率的是( )
A.增大反应物的量 B.升高温度 C.增大压强 D.使用催化剂
难度: 简单查看答案及解析
-
关于同分异构体的下列说法中不正确的是( )
A.具有相同分子式,但结构不同的化合物互为同分异构体
B.同分异构体现象是导致有机物数目众多的重要原因之一
C.同分异构体之间的转化属于化学变化
D.金刚石、石墨化学式相同,但结构不同,性质不同,所以互为同分异构体
难度: 简单查看答案及解析