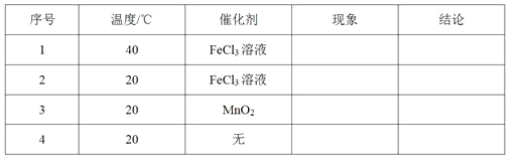
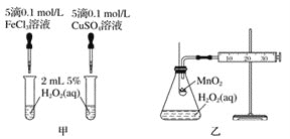
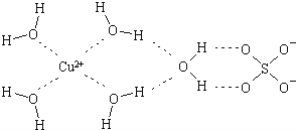
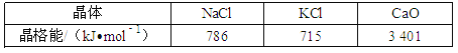-
室温下,有两种溶液:①0.01 mol·L-1 NH3·H2O溶液 ②0.01 mol·L-1 NH4Cl溶液,下列操作可以使两种溶液中c(NH4+)都增大的是( )
A.加入少量H2O B.加入少量NaOH固体
C.通入少量HCl气体 D.升高温度
难度: 简单查看答案及解析
-
银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器漫入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是
A. 处理过程中银器一直保持恒重
B. 银器为正极,Ag2S被还原生成单质银
C. 该过程中总反应为2Al+3Ag2S=6Ag+Al2S3
D. 黑色褪去的原因是黑色Ag2S转化为白色AgCl
难度: 简单查看答案及解析
-
同温同压下,已知下列各反应为放热反应,下列各热化学方程式中热量数值最小的是( )
A.2A(l)+B(l)=2C(g) ΔH1
B.2A(g)+B(g)=2C(g) ΔH2
C.2A(g)+B(g)=2C(l) ΔH3
D.2A(l)+B(l)=2C(l) ΔH4
难度: 中等查看答案及解析
-
下列说法正确的是
A. 非自发进行的反应一定不能发生
B. 自发进行的反应一定能迅速发生
C. 在一定条件下,非自发进行的反应也能发生
D. 吸热反应一定不能自发进行
难度: 中等查看答案及解析
-
热方程式C(s)+H2O(g)=CO(g)+H2(g)ΔH=131.3 kJ·mol-1表示( )
A. 碳和水反应吸收131.3kJ能量
B. 1mol碳和1mol水反应生成1mol一氧化碳和1mol氢气,并吸收131.3kJ热量
C. 1mol固态碳和1mol水蒸气反应生成1mol一氧化碳和1 mol氢气,并吸收131.3kJ热量
D. 1个固态碳原子和1分子水蒸气反应吸收131.3kJ热量
难度: 简单查看答案及解析
-
下列物质的水溶液因水解显碱性的是
A.NH4Cl B.NaOH C.CH3COOK D.CH3COOH
难度: 简单查看答案及解析
-
将FeCl3溶液蒸干灼烧,最后得到固体产物是()
A.无水FeCl3 B.Fe(OH)3 C.FeO D.Fe2O3
难度: 简单查看答案及解析
-
下列多电子原子不同能级能量高低的比较错误的是( )
A.1s<2s<3s B.2p<3p<4p C.3s<3p<3d D.4s>3d>3p
难度: 中等查看答案及解析
-
碱金属和卤素形成的化合物大多具有的性质是( )
①固态时不导电,熔融状态导电 ②能溶于水,其水溶液导电 ③低熔点 ④高沸点 ⑤易升华
A.①②③ B.①②④ C.①④⑤ D.②③④
难度: 中等查看答案及解析
-
下列各组物质全部都是强电解质的是( )
A.HF、HBr、HCl B.CH3COOH、H2S、HCN
C.Al(OH)3、Ba(OH)2、Na2SO4 D.CaCO3、HNO3、CuCl2
难度: 中等查看答案及解析
-
镁铝合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等,下列与这些用途无关的性质是( )
A.不易生锈 B.导电性好
C.密度小 D.强度高
难度: 简单查看答案及解析
-
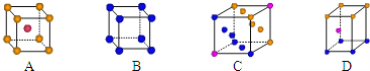
金属晶体中金属原子有三种常见的堆积方式,六方堆积、面心立方堆积和体心立方堆积,下图(a)、(b)、(c)分别代表这三种晶胞的结构,其晶胞内金属原子个数比为( )
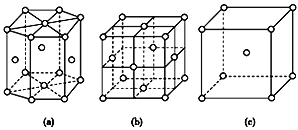
A.11∶8∶4
B.3∶2∶1
C.9∶8∶4
D.21∶14∶9
难度: 中等查看答案及解析
-
某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
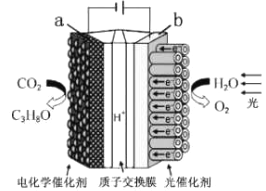
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1 mol O2,有44 gCO2被还原
D. a电极的反应为:3CO2+ 16H+-18e-= C3H8O+4H2O
难度: 中等查看答案及解析
-
现有3个体积相同的密闭容器,都进行下列反应:
气
,反应所处的温度相同,但起始的物质的量不同,其中甲:
mol;乙:
mol,
mol;丙:
气
达到平衡时,CO的物质的量由大到小的顺序是
A.甲
乙
丙 B.甲
丙
乙 C.乙
甲
丙 D.乙
丙
甲
难度: 困难查看答案及解析
-
反应X(g)+Y(g)
2Z(g) ΔH<0,达到平衡时,下列说法正确的是( )
A. 减小容器体积,平衡向右移动
B. 加入催化剂,Z的产率增大
C. 增大c(X),X的转化率增大
D. 降低温度,Y的转化率增大
难度: 简单查看答案及解析
-
下面关于能源的分类正确的是( )
A.化石能源是可再生能源 B.核能属于不可再生能源
C.太阳能是二次能源 D.电能是一次能源
难度: 中等查看答案及解析
-
已知原子数和价电子数相同的离子或分子结构相似,如SO3、NO都是平面三角形。那么下列分子或离子中与SO42-有相似结构的是( )
A. PCl5 B. CCl4 C. NF3 D. N
难度: 中等查看答案及解析
-
元素周期表中,有非金属元素的区域为( )
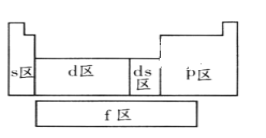
A. 只有s区 B. 只有p区 C. f区、d区和ds区 D. s区和p区
难度: 简单查看答案及解析
-
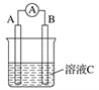
硝酸汞和碘化钾溶液混合后会生成红色的碘化汞沉淀,为了探究硝酸汞和碘化钾溶液之间能否发生氧化还原反应,研究人员设计了如图的实验装置,结果电流计指针发生了偏转,下列分析正确的是( )
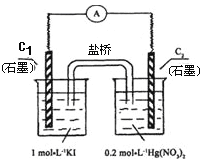
A.如图装置的电流方向是从C1到C2
B.C1是负极,发生的反应是2I-=I2+2e-
C.K+离子向C1电极流动
D.装置发生的总反应是Hg2++2I-=HgI2↓
难度: 中等查看答案及解析
-
下列措施或事实能用勒夏特列原理解释的是( )
A. 在合成氨(正反应是放热)的反应中,升温有利于氨的合成
B. H2、I2、HI三者的平衡混合气加压后颜色变深
C. 钢铁在潮湿的空气中更容易生锈
D. 含有酚酞的氨水中加入少量的氯化铵溶液的颜色变浅
难度: 中等查看答案及解析
-
某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。根据图中数据,下列有关说法错误的是( )
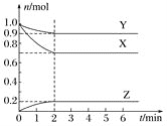
A.该反应的化学方程式为X+3Y⇌2Z
B.2 min时,反应达最大限度,但化学反应仍在进行
C.反应开始至2min,Z的反应速率为0.05 mol·L-1·min-1
D.反应达到平衡时,压强是开始时的0.9倍
难度: 中等查看答案及解析
-
下列不能根据元素电负性判断元素
A.是金属还是非金属
B.正负化合价
C.化学键类型
D.化合物溶解度
难度: 简单查看答案及解析
-
在蒸发皿中加热蒸干并灼烧下列物质的溶液,可以得到该物质的是
A.硫酸镁 B.碳酸氢钠 C.氯化铝 D.盐酸溶液
难度: 简单查看答案及解析
-
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=﹣Q1kJ•mol﹣1
2H2(g)+O2(g)=2H2O(g)ΔH=﹣Q2kJ•mol﹣1,
2H2(g)+O2(g)=2H2O(l) ΔH2=﹣Q3kJ•mol﹣1
常温下,取体积比2∶3的甲烷和氢气的混合气体11.2 L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为( )
A.0.4Q1+0.15Q2 B.0.2Q1+0.05Q2 C.0.2Q1+0.15Q3 D.0.2Q1+0.3Q2
难度: 中等查看答案及解析
-
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)
2HBr(g)
H<0;平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
A.a>b B.a=b C.a<b D.无法确定
难度: 中等查看答案及解析