-
以下能级符号正确的是:( )
A. 1p B. 2d C. 3f D. 4s
难度: 简单查看答案及解析
-
下列表达方式错误的是 ( )
A.

B.甲烷的电子式
C.硫离子的核外电子排布式 1s22s22p63s23p6
D.碳-12原子构成 C
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.第3周期所含的元素中钠的第一电离能最小
B.铝的第一电离能比镁的第一电离能大
C.在所有元素中,氟的第一电离能最大.
D.钾的第一电离能比镁的第一电离能大.
难度: 简单查看答案及解析
-
下列有关说法正确的是 ( )
A.通常用小黑点来表示电子的多少
B.小黑点密表示在该核外空间的电子数多
C.小黑点密表示在该核外空间的单位体积内电子出现的概率大
D.通常用小黑点来表示绕核作高速圆周运动
难度: 简单查看答案及解析
-
在常温常压下呈气态的化合物,降温固化得到的晶体属于:( )
A. 原子晶体 B. 分子晶体
C. 离子晶体 D. 金属晶体
难度: 简单查看答案及解析
-
下列各组粒子不能互称为等电子体的是:( )
A.CO和N2 B.O3和SO2
C.CO2和N2O D.N2H4和 C2H4
难度: 简单查看答案及解析
-
下列说法中,错误的是( ).
A.键长越长,化学键越牢固
B.成键原子间原子轨道重叠越多,共价键越牢固
C.对双原子分子来讲,键能越大,含有该键的分子越稳定
D.原子间通过共用电子对所形成的化学键叫共价键
难度: 简单查看答案及解析
-
能够用键能解释的是( )
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液体,碘为固体
C.稀有气体一般很难发生化学反应
D.硝酸易挥发,硫酸难挥发
难度: 简单查看答案及解析
-
向下列配合物的水溶液中加入AgNO3溶液,不能生成 AgCl沉淀的是( )
A. [Co(NH3) 4Cl2] Cl B. [Co(NH3) 3Cl3]
C. [Co(NH3) 6] Cl3 D. [Co(NH3) 5Cl] Cl
难度: 简单查看答案及解析
-
、把下列液体分别装在酸式滴定管中,并使其以细流流下,当用带有静电的玻璃棒接近液体细流时,细流可能发生偏转的是( )
A.CCl4 B. CH3CH2OH
C. CS2 D. 苯( C6H6 )
难度: 简单查看答案及解析
-
下列关于氢键的说法中正确的是( )
A. 每个水分子内含有两个氢键
B. 在所有的水蒸气、水、冰中都含有氢键
C. 分子间能形成氢键,使物质的熔沸点升高
D. HF稳定性很强,是因为其分子间能形成氢键
难度: 简单查看答案及解析
-
关于晶体的下列说法中正确的是( )
A.在离子晶体中只要有阴离子就一定有阳离子
B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔沸点一定比金属晶体的高
D.分子晶体的熔点一定比金属晶体的低
难度: 简单查看答案及解析
-
下列物质中,化学式能准确表示该物质分子组成的是( )
A. NH4Cl B. SiO2
C. P4 D. Na2SO4
难度: 简单查看答案及解析
-
下列化合物中含有手性碳原子的是( )
A.CCl2F2 B.
C.CH3CH2OH D.CH3——COOH
难度: 简单查看答案及解析
-
在乙烯分子中有σ键和π键,下列说法不正确的是:
A.中心原子采用sp2杂化
B.乙烯分子中有4个σ键和2个π键
C.杂化轨道形成σ键、未杂化的2p轨道形成π键
D.乙烯分子中所有原子一定在同一平面
难度: 简单查看答案及解析
-
用价层电子对互斥理论预测CO32-和BF3的立体结构分别是:
A.平面三角形;三角锥形 B.三角锥形;平面三角形
C.三角锥形;三角锥形 D.平面三角形;平面三角形
难度: 简单查看答案及解析
-
下列各组物质中,化学键类型相同,晶体类型也相同的是:
A. C(金刚石)和CO2 B. NaBr和HBr
C. Cl2和KCl. D. CH4和H2O
难度: 简单查看答案及解析
-
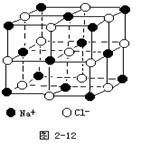
下面有关离子晶体的叙述中,不正确的是( )
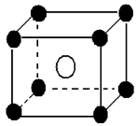
A.1mol氯化钠中有NA个NaCl分子
B.氯化钠晶体中,每个Na+周围距离相等的Na+共有12个
C.氯化铯晶体中,每个CS+周围紧邻8个Cl-
D.平均每个NaCl晶胞中有4个Na+、4个Cl-
难度: 简单查看答案及解析