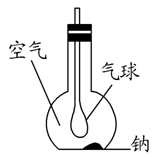
-
对危险化学品要在包装标签上印有警示性标志。氰化钾(KCN)应选用的标志是
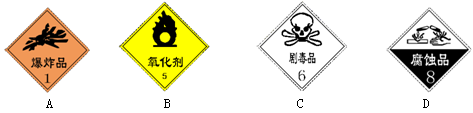
难度: 简单查看答案及解析
-
下列物质的分类合理的是
A.氧化物:CaO、Al2O3 B.铵盐:NH3·H2O、NH4Cl
C.酸:H2SO4、NaHSO4 D.碱:NaOH、Na2CO3
难度: 中等查看答案及解析
-
将饱和氯化铁溶液分别滴入下列液体中,能形成胶体的是
A.冷水 B.氯化钠溶液 C.沸水 D.氢氧化钠溶液
难度: 中等查看答案及解析
-
下列实验操作或方法,不正确的是
A.用蒸馏的方法制取蒸馏水
B.用酒精萃取饱和碘水中的碘单质
C.使用分液漏斗分离水和四氯化碳的混合物
D.过滤时玻璃棒的末端应轻轻靠在三层的滤纸上
难度: 简单查看答案及解析
-
配制100 mL 0.10 mol·L-1的NaOH溶液时,下列实验操作会使所配溶液浓度偏大的是
A.转移溶液时有液体飞溅
B.在容量瓶中定容时俯视刻度线
C.定容时凹液面最底处高于刻度线
D.转移溶液后未洗涤烧杯就直接定容
难度: 中等查看答案及解析
-
下列常用实验仪器中,不能直接用于混合物的分离或提纯的是
A.分液漏斗 B.蒸发皿 C.蒸馏烧瓶 D.容量瓶
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述正确的是
A.27 g铝原子最外层电子数为2NA
B.2. 4g镁与足量盐酸反应转移的电子数为0.1NA
C.1 molH2O分子所含电子数为10NA
D.标准状况下,22.4 L乙醇的分子数为NA
难度: 中等查看答案及解析
-
将2mol·L-1盐酸10mL稀释到200mL,再取出1mL,这1mL溶液的物质的量浓度是
A.0.05mol·L-1 B.0.25mol·L-1 C.0.1mol·L-1 D.0.5mol·L-1
难度: 中等查看答案及解析
-
关于0.2mol·L-1的NaCl溶液,下列说法不正确的是
A.100mL该溶液中含1.17gNaCl
B.该溶液中Na+的物质的量浓度是0.2mol·L-1
C.1000mL该溶液中约含0.2×6.02×1023个Na+
D.配制含1L水的该溶液,需NaCl的质量为11.7g
难度: 中等查看答案及解析
-
胶体区别于溶液的最本质特征是
A.可以通过滤纸 B.胶体有丁达尔效应
C.胶体粒子带有电荷 D.胶体粒子的直径在1~100 nm之间
难度: 简单查看答案及解析
-
下列物质均属于电解质的一组是
A. NaCl、BaSO4 B.CH4、NH3 C.Al、Fe、Cu D.C2H5OH、CuSO4
难度: 中等查看答案及解析
-
下列物质溶于水,其电离方程式正确的是
A.NaHCO3===Na++H++CO32- B.(NH4)2SO4===NH4++2SO42-
C.NaCl===Na++Cl- D.Ca(OH)2===Ca2++OH2-
难度: 中等查看答案及解析
-
下列离子方程式中,错误的是
A.铜丝与硝酸银溶液反应:Cu + Ag+ = Cu2+ + Ag
B.氧化铝与稀盐酸混合:Al2O3 + 6H+ = 2Al3+ + 3H2O
C.稀盐酸与氢氧化钠溶液混合:H+ + OH— = H2O
D.钠与水反应:2Na+ 2H2O = 2Na+ +2OH— + H2↑
难度: 中等查看答案及解析
-
在强酸性无色透明溶液中,下列各组离子能大量共存的是
A.Cu2+、K+、Cl-、NO3- B.Ag+、Na+、NO3-、Cl-
C.Na+、Al3+、SO42-、Cl- D.Ba2+、NH4+、Cl-、CO32-
难度: 中等查看答案及解析
-
同温同压下,甲容器中装有56gN2,乙容器中装有16gCH4,则甲、乙两容器的体积比为
A.1:1 B.2:1 C.3:1 D.4:1
难度: 中等查看答案及解析
-
在空气中敞口放置后,溶液质量会增加的是
A.浓盐酸 B.浓硫酸 C.浓硝酸 D.浓醋酸
难度: 简单查看答案及解析
-
取一块金属钠放在燃烧匙里加热,观察到下列实验现象:①金属先熔化 ②在空气中燃烧 放出黄色火花 ③燃烧后得白色固体 ④燃烧时火焰为黄色 ⑤燃烧后生成浅黄色固体物质,描述正确的是
A.①② B.①③④ C.①④ D.①④⑤
难度: 简单查看答案及解析
-
下列反应中,属于氧化还原反应但不属于四种基本反应类型的是
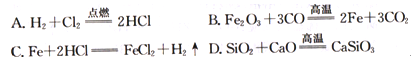
难度: 中等查看答案及解析
-
配制一定物质的量浓度的NaOH溶液时,下列操作会使所配制溶液的浓度偏小的是
①在滤纸上称取NaOH固体;②向容量瓶中转移溶液时有少量溅出;③转移溶液时未洗涤烧杯和玻璃棒;④定容摇匀时液面下降;⑤定容时俯视容量瓶刻度线;⑥定容时仰视容量瓶刻度线
A.①③④⑤ B.①②③⑥ C.②③④⑥ D.①②④⑤
难度: 中等查看答案及解析
-
高铁方便了人们的出行。焊接钢轨涉及如下反应:2Al+Fe2O3
2Fe+A12O3下列有关该反应的说法不正确的是
A.Al是还原剂 B.Fe2O3是氧化剂
C.Fe2O3本身被氧化 D.该反应属于置换反应
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.含最高价元素的化合物,一定具有强氧化性
B.阳离子只有氧化性,阴离子只有还原性
C.失去电子多的还原剂还原性强
D.化学反应中,某元素由化合态变为游离态,此元素可能被氧化
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值.下列说法正确的是
A.25℃、101 kPa时,64g SO2中含有的氧原子数为3NA
B.5.6g金属铁与足量稀盐酸反应,转移的电子数为0.3NA
C.标准状况下,ll.2 LH2O含有的分子数为0.5NA
D.常温常压下,92g NO2和N2O4混合气体含有的原子数为6NA
难度: 中等查看答案及解析
-
向FeCl3溶液中加入过量的Cu,反应结束后,溶液中大量存在的金属离子是
A.Fe2+、Cu2+ B.Fe3+、Fe2+ C.Cu+、Cu2+ D.Cu2+、Fe3+
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列物质所含分子数最少的是
A.0.8 mol O2 B.标准状况下2.24 L CO2 C.3.6g H2O D.含NA个分子的NH3
难度: 中等查看答案及解析
-
保存少量金属钠的方法
A.浸入水中 B.浸入煤油中 C.浸入酒精中 D.放入细沙中
难度: 简单查看答案及解析
-
离子方程式CO32-+2H+===H2O+CO2↑中的CO32-代表的物质可以是
A.CaCO3 B.NaHCO3 C.Na2CO3 D.BaCO3
难度: 简单查看答案及解析
-
下列各组物质中,按混合物、化合物、单质顺序排列的是
A.纯碱、食盐、铁 B.石油、煤、天然气
C.空气、氯化氢、液氧 D.冰水共存物、干冰、氮气
难度: 简单查看答案及解析
-
将钠、铁、铝各0.3 mol分别放入l00 mLl mol/L盐酸中,同温同压下产生气体的体积比是
A.1︰2︰3 B.6︰3︰2 C. 1︰1︰1 D.3︰1︰1
难度: 简单查看答案及解析
-
下列关于钠的叙述中,不正确的是
A.钠燃烧时生成氧化钠 B.钠燃烧时发出黄色的火焰
C.钠有很强的还原性 D.钠原子的最外层只有一个电子
难度: 简单查看答案及解析
-
下列变化需要加入氧化剂才能实现的是
A.NaOH→NaCl B.H2SO4→H2 C.HCl→Cl2 D.CaCO3→CO2
难度: 简单查看答案及解析