-
在一定条件下,一密闭容器内发生某反应,测得反应前后各物质的质量如下表所示。下列说法错误的是( )
物质
a
b
c
d
反应前的质量/g
30
5
10
15
反应后的质量/ g
x
y
20
20
A. a一定是反应物
B. x+y=20
C. x的取值范围一定是0≤x≤30
D. 反应生成c与d的质量比为2∶1
难度: 中等查看答案及解析
-
下列有关水的说法中不正确的是( )
A. 水(H20)和过氧化氢(H202)分子中都含有氢气分子
B. 电解水实验证明水是由氢、氧两种元素组成的
C. 用肥皂水可以区分软水和硬水
D. 常用吸附、沉淀、过滤和蒸馏等方法净化水
难度: 中等查看答案及解析
-
成语是中华传统文化的瑰宝。下列成语中包含化学变化的是
A. 百炼成钢 B. 滴水成冰 C. 草木皆兵 D. 刻舟求剑
难度: 简单查看答案及解析
-
下列气体不是空气中固定成分的是
A. 氧气 B. 氮气 C. 二氧化硫 D. 稀有气体
难度: 简单查看答案及解析
-
臭氧是由于氮氧化物等在阳光照射下发生光化学反应产生的。下列说法错误的是
A. 臭氧与氧气的化学性质不同 B. 臭氧是空气质量指数的污染物之一
C. 汽车尾气大量排放会导致臭氧污染 D. 佩戴口罩能有效阻挡臭氧的吸入
难度: 中等查看答案及解析
-
我国古代典籍中有“银针验毒”的记载,“银针验毒”的反应原理之一是: 4Ag+2H2S+O2=2X+2H2O。下列有关该反应的说法不正确的是
A. 过程中发生了氧化反应 B. 反应前后元素的种类不变
C. X的化学式是Ag2S D. 反应前后所有元素的化合价都发生了变化
难度: 中等查看答案及解析
-
“金山银山不如绿水青山”,为了控制温室效应和改善生存环境,下列措施中切实可行的是
①禁止使用煤等燃料;②禁止乱砍乱伐;③禁止使用农药和化肥;④开发新能源;⑤利用水力发电;⑥种植花草树木。
A. ③④⑤⑥ B. ①②③④⑥ C. ①④⑤⑥ D. ②④⑤⑥
难度: 简单查看答案及解析
-
2017年5月,中科院、国家语委和全国科技名词委正式定名118号元素为“
”,其部分信息如图所示。则下列关于
的说法正确的是( )
A. 元素符号为Og
B. 相对原子质量为118
C. 原子的核电荷数为179
D. 原子的核外电子数为297
难度: 简单查看答案及解析
-
中华古代文化蕴含着丰富的化学知识,下面理解不合理的是
选项
文摘
理解
A
露从今夜白,月是故乡明
描述中有物理变化
B
暖暖远人村,依依墟里烟
描述中有化学变化
C
金(即钢)柔锡柔,合两柔则刚
合金的熔点比组成它的纯金属高
D
一尺之棰,日取其半,万世不竭
蕴含着物质无限可分的思想
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
正确的实验操作对实验结果、人身安全都非常重要。下列操作正确合理的是 ( )
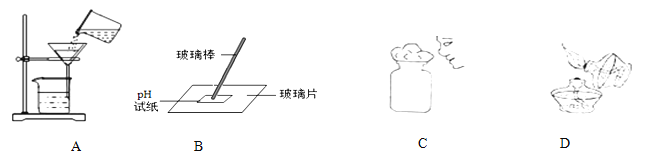
A. 液体过滤 B. 测定溶液的pH C. 闻气体气味 D. 点燃酒精灯
难度: 简单查看答案及解析
-
推理是研究和学习化学的重要方法。以下推理正确的是
A. 可燃物燃烧时温度需要达到着火点,所以温度达到着火点时,可燃物就一定能燃烧
B. 过滤可以除去水中不溶性杂质,因此过滤后的水一定是软水
C. 催化剂在反应前后质量不变,因此反应前后质量不变的物质一定是催化剂
D. 不锈钢虽然是金属材料,但它属于混合物而不是金属单质
难度: 困难查看答案及解析
-
为及时发现燃气泄漏,常在燃气中加入少量有特殊气味的乙硫醇(C2H5SH),乙硫醇也可以充分燃烧,化学方程式为:2C2H5SH+9O2
4CO2+2X+6H2O。下列关于X的说法正确的是
A. X由碳、硫、氧三种元素组成 B. X属于有机化合物
C. X中硫、氧元素的原子个数比为1:2 D. X中氧元素的质量分数为60%
难度: 中等查看答案及解析
-
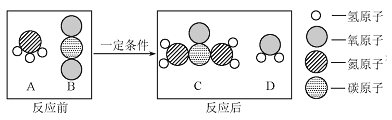
下图中“
”和“
”分别表示氢原子和氮原子,能保持氨气化学性质的微粒是( )

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
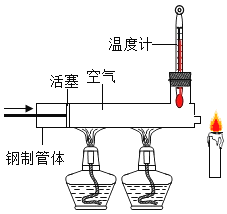
小东通过查阅资料,根据铁在空气中生锈的原理,设计了如右图所示的实验装置,来测定空气中氧气含量(装置中的饱和食盐水、活性炭会加速铁生锈)。已知广口瓶有效容积为242mL,实验8分钟后打开止水夹,水从烧杯流入广口瓶中的体积为48mL。下列说法错误的是

A. 该实验的不足之处在于实验前广口瓶底未放少量水
B. 通过分析本次实验数据,可知空气中氧气的体积分数约19.8%
C. 若实验药品充足,时间足够长,可十分接近拉瓦锡实验的结果
D. 此实验可有效解决拉瓦锡实验中的汞污染问题
难度: 中等查看答案及解析
-
李涛同学撰写的“心目中的原子”短文中,阐述了以下观点,你认为不正确的是
A. 原子可以转化为离子 B. 原子是最小的微观粒子
C. 有些物质是由原子构成的 D. 原子可以“搭建”成分子
难度: 简单查看答案及解析
-
如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是

A. t1℃时,把甲的不饱和溶液变为饱和溶液,溶剂质量一定不变
B. t2℃时,甲、乙两种物质饱和溶液的溶质质量分数一定相等
C. 将t1℃时的甲、乙、丙三种物质的饱和溶液升温到t2℃,三种溶液的溶质质量分数大小关系是:甲=乙>丙
D. 若甲中混有少量乙,可采用蒸发结晶的方法提纯甲
难度: 中等查看答案及解析
-
下列各组物质在水溶液中能大量共存的是( )
A.NH4Cl、K2CO3、NaOH B.HCl、Na2SO4、KOH
C.BaCl2、KCl、CuSO4 D.K2SO4 、NH4HCO3 、NaCl
难度: 中等查看答案及解析
-
2017年,联合国把世界水日的主题定为“废水”,关注重点是寻找各种方式来减少和再利用废水。以下对不同工业废水的处理措施及对应的方法类别,都正确的是 ( )
选项
废水中的主要污染物
处理措施
方法类别
A
不溶性颗粒物
加明矾
结晶法
B
异味物质
加活性炭
吸附法
C
氯化铜
加硫酸钠
过滤法
D
纯碱
加石灰水
蒸馏法
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示,下列说法中正确的是

A. c点对应溶液中含有的金属离子为Zn2+和Cu2+
B. bc段(不含两端点)析出的金属是Fe
C. ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、Cu2+和Fe2+
D. 若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,则m1>m2
难度: 中等查看答案及解析
-
下列实验方案不能达到实验目的的是
实验目的
实验方案
A
验证铝、铜、银三种金属的活动性顺序
将洁净的铜丝分别浸入硫酸铝溶液和硝酸银溶液中
B
用一种试剂一次性鉴别出稀硫酸、澄清石灰水和碳酸钠溶液
分别取样,滴加紫色石蕊试液
C
除去炭粉中混有的少量氧化铜
加入足量的稀硫酸,过滤、洗涤、干燥
D
除去KCl固体中的MnO2
溶解、过滤和蒸发
A. A B. B C. C D. D
难度: 困难查看答案及解析
 ,当x-y=8时,该粒子的符号为_____________;
,当x-y=8时,该粒子的符号为_____________;



