-
中国丝绸有五千年的历史和文化.古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐,能促进蚕丝表层的丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮.这种“碱剂”可能是
A.食盐 B.火碱 C.草木灰 D.胆矾
难度: 简单查看答案及解析
-
下列用品的主要成分及其用途对应不正确的是
A
B
C
D
用品




主要成分
Ca(ClO)2
NaHCO3
Si
Fe2O3
用途
做消毒剂
干燥剂
光电池
涂料
难度: 中等查看答案及解析
-
茅台九中存在少量具有凤梨香味的物质X,其结构如下图所示。下列说法正确的是
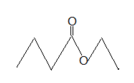
A.X难溶于乙醇
B.酒中的少量丁酸能抑制X的水解
C.分子式为 C4H8O2且官能团与X相同的物质有5种
D.X完全燃烧后生成CO2和H2O的物质的量比为1∶2
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数值,下列有关叙述正确的是
A.28 g乙烯和丙烯混合气体中的碳原子数为2NA
B.1 molN2与4 molH2反应生成的NH3分子数为2NA
C.1 molFe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24 LCCl4含有的共价键数为0.4NA
难度: 简单查看答案及解析
-
下列各组离子能在水溶液中大量共存的是
A.Ca2+、SO42-、H+、HCO3- B.H+、NO3-、Cl-、SiO32-
C.K+、Fe2+、H+、NO3- D.K+、Na+、CO32-、SiO32-
难度: 简单查看答案及解析
-
下列有关反应或对事实解释的离子方程式不正确的是
A.盛放NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-=SiO32-+H2O
B.双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O
C.用铜作电极电解CuSO4溶液:2Cu2++2H2O
2Cu+O2↑+4H+
D.消毒液与洁厕灵(主要成分是HCl)混用,产生有毒Cl2:2H++Cl-+ClO-=Cl2+H2O
难度: 简单查看答案及解析
-
用下图所示实验装置进行相应实验,能达到实验目的的是

A.用图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体
B.按装置②所示的气流方向可用于收集H2、NH3等
C.用图④所示装置,分离CCl4萃取I2水后的有机层和水层
D.用图④所示装置,可以证明氧化性Cl2>Br2>I2
难度: 中等查看答案及解析
-
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
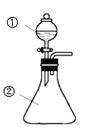
选项
①中物质
②中物质
预测②中的现象
A
稀盐酸
碳酸钠与氢氧化钠的混合溶液
立即产生气泡
B
浓硝酸
用砂纸打磨过的铝条
产生红棕色气体
C
氯化铝溶液
浓氢氧化钠溶液
产生大量白色沉淀
D
草酸溶液
酸性高锰酸钾溶液
溶液逐渐褪色
难度: 中等查看答案及解析
-
实验室中,从海带中提取I2的实验流程如下图所示,下列说法不正确的是

A:操作①用到的玻璃仪器有:烧杯、玻璃棒、漏斗
B.操作②中需加入氧化剂
C.可以用四氯化碳或酒精代替苯作萃取剂
D.蒸馏I2的苯溶液可获取I2并回收苯
难度: 中等查看答案及解析
-
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A.Cu与Cu2O 的物质的量之比为2:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
难度: 困难查看答案及解析
-
加热HCOONa固体,发生的反应有:
2HCOONa=Na2C2O4+H2↑ ①
2HCOONa=Na2CO3+H2↑+CO↑ ②
Na2C2O4=Na2CO3+CO↑ ③
HCOONa加热分解时,固体失重率与温度的关系如下图所示。下列说法正确的是
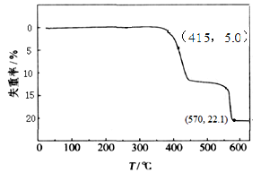
A.T<415℃时,只有反应①发生
B.反应①、②不可能同时发生
C.570℃<T<600℃时,残留固体的主要成分是Na2CO3
D.Na2C2O4、HCOONa、Na2CO3中碳元素的化合价依次升高
难度: 困难查看答案及解析
-
锌-空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O=2Zn(OH)42-。下列说法正确的是
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-)逐渐减小
C.放电时,负极反应为:Zn+4OH–-2e–=Zn(OH)42-
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 中等查看答案及解析
-
金属元素在元素世界中占有十分重要的地位,Al、Fe、Cu都是重要的金属元素。下列说法正确的是
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中均只生成氧化物
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Al 、Fe、Cu
难度: 简单查看答案及解析
-
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
A.脱氧过程是吸热反应,可降低温度,延长糕点保质期
B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e→Fe3+
C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e→4OH-
D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况)
难度: 中等查看答案及解析
-
氢能是理想的清洁能源,通过以下反应均可获取H2。下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l)═2H2(g)+O2(g) △H1=571.6kJ•mol-1
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g) △H2=131.3kJ•mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g) △H3=206.1kJ•mol-1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,△H3减小
D.反应CH4(g)=C(s)+2H2(g)的△H=74.8kJ•mol-1
难度: 简单查看答案及解析
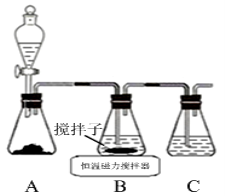

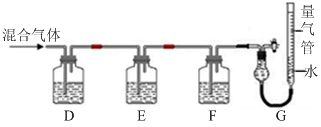
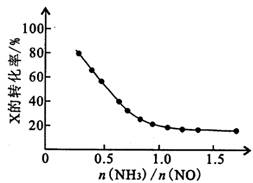
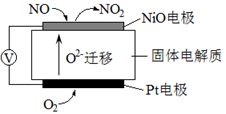
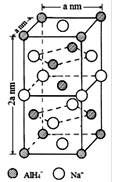
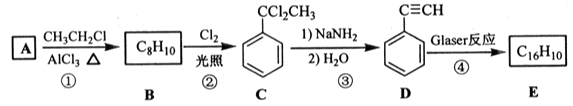
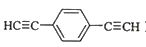 )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。