-
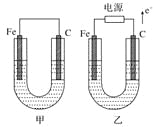
下列各组的比值等于2∶1的是
A.pH值均为12的烧碱溶液与氢氧化钡溶液的物质的量浓度之比
B.硫化钾溶液中c(K+)与c(S2-)之比
C.相同温度下,0.2mol·L-1的醋酸溶液与0.1mol·L-1的醋酸溶液中的c(H+)之比
D.10mL 0.5mol·L-1的盐酸溶液与5mL 0.5mol·L-1的醋酸溶液中的n(H+)之比
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 需要加热才能发生的反应一定是吸热反应
B. 化学反应中的能量变化都表现为热量变化
C. 任何放热反应在常温下一定能发生
D. 反应物和生成物所具有的总能量决定了反应是放热还是吸热
难度: 简单查看答案及解析
-
下列叙述正确的是
①锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率
②镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀
③电镀时,应把镀件置于电解槽的阴极
④冶炼铝时,用电解熔融氧化铝的方法
⑤钢铁表面常易锈蚀生成Fe2O3•nH2O
A.①②③④⑤ B.①③④⑤ C.①③⑤ D.②④
难度: 中等查看答案及解析
-
在一定条件下,反应N2+3H2
2NH3,在2L密闭容器中进行,5min内氨的物质的量增加了1mol,则反应速率为
A.υ(H2)= 0.3 mol/(L·min) B.υ(N2)=0.2mol/(L·min)
C.υ(NH3)=0.2 mol/(L·min) D.υ (NH3)=0.1mol/(L·min)
难度: 简单查看答案及解析
-
将a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两相连。若a、d相连,a为负极;c、d相连,c极产生大量气泡;b、c相连,b为正极;则这四种金属中金属性最强的是( )
A.a B.b C.c D.d
难度: 简单查看答案及解析
-
化学与生产、生活密切相关,下列叙述错误的是
A.用热的纯碱溶液清除灶具上的油污
B.用硫酸清洗锅炉中的水垢
C.用明矾[KAl(SO4)2.12H2O]作净水剂,除去水中悬浮的杂质
D.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+
难度: 中等查看答案及解析
-
已知CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH== - Q1 ;
2H2(g)+O2(g) →2H2O(g) ΔH== - Q2;
H2O(g) →H2O(l) ΔH== - Q3
常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为
A.4Q1+0.5Q2 B.4Q1+Q2+10Q3 C.4Q1+2Q2 D.4Q1+0.5Q2+9Q3
难度: 中等查看答案及解析
-
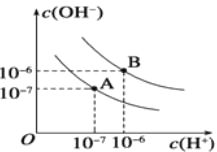
在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶掖等体积混合后,下列关系式中正确的是
A.c(Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)==c(CH3COO-)+c(OH一)
C.c(Na+) >c(CH3COO-)>c(OH-)>c(H+)
D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
下列反应是工业生产硝酸的一个反应过程,4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH=-1025 kJ/mol,若反应物起始的物质的量相同。下列关于该反应的示意图不正确的是
A.
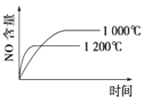 B.
B.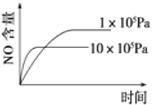
C.
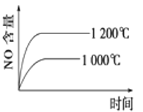 D.
D.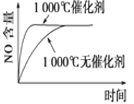
难度: 中等查看答案及解析
-
一定温度下,可逆反应N2(g)+3H2(g)⇌2NH3(g)达到平衡状态标志的是( )
A.A、B、C的分子数之比为1:3:2
B.单位时间内生成amol N2,同时生成amolNH3
C.每断裂1molN≡N,同时断裂3molH﹣H
D.每生成1mol N≡N,同时生成6molN﹣H
难度: 简单查看答案及解析
-
等物质的量浓度的下列物质的溶液,其pH由小到大的顺序排列正确的是( )
①CH3COONa ②NaOH ③NaNO3 ④HCl ⑤Al2(SO4)3
A.①②③④⑤ B.⑤④③②① C.④⑤③①② D.④⑤②①③
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.工业上常通过电解熔融的MgO冶炼金属镁
B.应用盖斯定律,可计算某些难以直接测量的反应焓变
C.用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2
D.在铁上镀铜,应选用铜作阴极
难度: 中等查看答案及解析
-
常温下,将pH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的NaOH溶液,两者pH都升高了1。则加入水和加入NaOH溶液的体积比约为( )
A.11∶1 B.10∶1 C.6∶1 D.5∶1
难度: 中等查看答案及解析
-
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中0.1molCu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为
A. 0.1mol B. 0.2mol C. 0.3mol D. 0.4mol
难度: 困难查看答案及解析
-
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e-+ H2O = CH3COOH + 4H+。下列有关说法正确的是
A. 检测时,电解质溶液中的H+向负极移动
B. 若有0.4mol电子转移,则在标准状况下消耗4.48L氧气
C. 电池反应的化学方程式为:CH3CH2OH + O2= CH3COOH + H2O
D. 正极上发生的反应为:O2+ 4e-+ 2H2O = 4OH-
难度: 中等查看答案及解析
-
常温常压时烯烃与氢气混合不反应,高温时反应很慢,但在适当的催化剂存在时可氢气反应生成烷,一般认为加氢反应是在催化剂表面进行。反应过程的示意图如下:
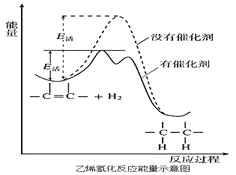

下列说法中正确的是
A.乙烯和H2生成乙烷的反应是吸热反应
B.加入催化剂,可减小反应的热效应
C.催化剂能改变平衡转化率,不能改变化学平衡常数
D.催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体
难度: 中等查看答案及解析