-
下列离子方程式书写正确的是
A. 向Na2CO3 溶液中加入过量CH3COOH溶液:CO32- + 2H+ = CO2↑+H2O
B. 少量CO2 通入Ca(ClO)2 溶液中:ClO- + CO2+ H2O = HCO3- + HClO
C. 钠与水反应: 2Na + 2H2O=2Na+ + 2OH- + H2↑
D. 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+ H2O
难度: 简单查看答案及解析
-
将CO2气体通入下列溶液中,联系所学知识推测一定不会出现浑浊的是
A. 饱和Na2CO3溶液 B. CaCl2溶液 C. 澄清石灰水 D. Na2SiO3溶液
难度: 中等查看答案及解析
-
下列关于某溶液中所含离子的检验,判断正确的是
A. 取样,加入2滴KSCN溶液,溶液不显红色,再向其中滴加几滴新制的氯水,溶液变为红色,则该溶液中一定含有Fe2+
B. 取样,加入BaCl2溶液,生成白色沉淀,加足量稀硝酸沉淀不消失,则该溶液中一定含有SO42-
C. 用洁净的铂丝蘸取溶液在火焰上灼烧,火焰呈黄色,则原溶液中一定不含有K+
D. 取样,加入足量盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32-
难度: 困难查看答案及解析
-
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水.工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2FeCl3+10NaOH+3NaClO = 2Na2FeO4+9NaCl+5H2O,② Na2FeO4 + 2KOH = K2FeO4 + 2NaOH .下列说法不正确的是
A. 反应①为氧化还原反应,反应②为复分解反应
B. 反应①中NaClO 是氧化剂
C. 反应②的产物K2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒
D. 若有2 mol FeCl3 发生反应,转移电子的物质的量为 6 mol
难度: 中等查看答案及解析
-
在空气中长时间放置少量金属钠,最终的产物是
A. Na2O B. NaOH C. Na2CO3 D. Na2O2
难度: 中等查看答案及解析
-
在无色透明的溶液中,可以大量共存的离子组是
A. MnO4-、Fe2+、K+、Cl- B. Cu2+、Na+、Cl-、SO42-
C. Ca2+、Cl-、NO3-、K+ D. Ca2+、Na+、OH-、HCO3-
难度: 简单查看答案及解析
-
已知常温下在溶液中可发生如下两个离子反应:Ce4++Fe2+=Fe3++Ce3+,Sn2++2Fe3+=2Fe2++Sn4+,由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是 ( )
A.Sn2+ 、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+ 、Sn2+ D.Fe2+、Sn2+、Ce3+
难度: 中等查看答案及解析
-
下列各组物质中,因为反应条件或用量不同而发生不同化学反应的是( )
① C与O2 ② Na与O2 ③ Fe与Cl2 ④ AlCl3溶液与氨水 ⑤ CO2与NaOH溶液
A.除③外 B.除③⑤外 C.除③④外 D.除②外
难度: 中等查看答案及解析
-
中国人自古就有泡药酒的习惯。药酒多选用50-60度的白酒,将中药材浸泡在酒中,经过一段时间,中药材中的有效成分(主要是有机物)溶解在酒中,此时即可过滤去渣后饮用。泡药酒的原理属于

A.萃取 B.结晶 C.干燥 D.置换
难度: 简单查看答案及解析
-
下列实验操作与安全事故处理不正确的是( )
A.用试管夹从试管底部由下往上夹住距试管口约1/3处,手持试管夹长柄末端进行加热
B.将CO中毒者移动到通风处抢救
C.实验中剩余的钠不能再放回原试剂瓶
D.蒸馏烧瓶加热时需要垫石棉网
难度: 中等查看答案及解析
-
化学与生产、生活密切相关。下列与化学相关的说法正确的是 ( )
A.水泥、陶瓷、水晶均属于硅酸盐产品
B.医用酒精和Fe(OH)3胶体可用丁达尔效应区分
C.氯水和食盐水消毒杀菌的原理相同
D.盐酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
难度: 中等查看答案及解析
-
同温同压,相同体积的CO和C2H4具有相同的:
①分子数 ②原子总数 ③碳原子数 ④质量
A.①②③④ B.②③④ C.①②③ D.①④
难度: 中等查看答案及解析
-
下列溶液中Cl-的物质的量浓度最大的是
A. 150 mL1 mol/L NaCl溶液 B. 50 mL2mol/L NH4Cl溶液
C. 150 mL 0.5 mol/L CaCl2溶液 D. 50 mL l mol/L AlCl3溶液
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.56g铁粉在氯气中充分燃烧时转移电子数等于2NA
B.1 molNa2O2与足量CO2反应,转移了4NA个电子
C.标准状况下,2.24 LCl2被NaOH溶液吸收,转移电子数为0.2NA
D.16g氧气与臭氧(分子式为O3)的混合气体中,含有NA个氧原子
难度: 中等查看答案及解析
-
下列物质性质或反应在生活中的应用错误的是 ( )
A.合金具有优良性能,熔点一般低于其组分金属
B.氧化铁俗称铁红,可用作红色油漆和外墙涂料
C.二氧化硅是制造光电池的常用材料
D.HF可用作在玻璃器皿上刻蚀标记
难度: 中等查看答案及解析
-
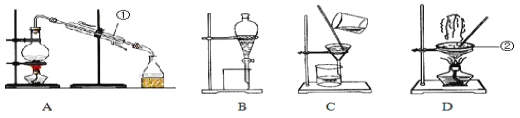
下列实验能达到目的的是
A
B
C
D
实验室制备Fe(OH)2
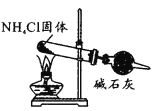
实验室制氨气
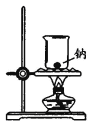
制过氧化钠
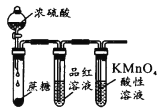
验证浓H2SO4的脱水性、强氧化性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列叙述中,不正确的是( )
A.久置在空气中的NaOH溶液,加盐酸时有气体产生
B.50 mL 12 mol·L-1的浓盐酸与足量的MnO2反应,生成Cl2的量小于0.15 mol
C.在常温下,浓H2SO4不与Cu反应,是因为铜被钝化
D.用浓氨水可检验氯气管道是否漏气
难度: 中等查看答案及解析
-
下列有关物质检验的实验操作与现象能得到对应结论的是 ( )
操作
现象
结论
A.
铝片放入浓硫酸中
无明显变化
铝与冷的浓硫酸不发生
化学反应
B.
用坩埚钳夹住一小块用砂纸打磨过的铝箔在酒精灯上加热
铝熔化但不滴落
Al2O3的熔点高于Al
C.
铝、镁分别投入相同浓度的NaOH溶液
铝片溶解
铝比镁更活泼
D.
将Cl2通入盛有湿润红色布条的洗气瓶
红色布条褪色
Cl2具有漂白性
A.A B.B C.C D.D
难度: 中等查看答案及解析