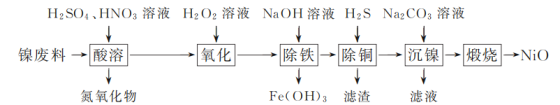
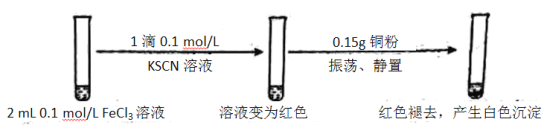
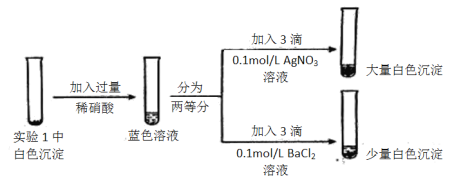
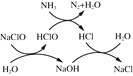
-
下图所示为工业合成氨的流程图。有关说法错误的是
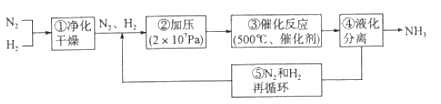
A. 步骤①中“净化”可以防止催化剂中毒
B. 步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率
C. 步骤③、④、⑤均有利于提高原料平衡的转化率
D. 产品液氨除可生产化肥外,还可用作制冷剂
难度: 简单查看答案及解析
-
下列说法正确的是
A.氢氧燃料电池放电时化学能全部转化为电能
B.反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应ΔH>0
C.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
D.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
难度: 简单查看答案及解析
-
CO2与CH4可制得合成气:CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH=+247 kJ·mol-1。初始温度均为T K时,在3个容器中按不同方式投入反应物,发生上述反应,相关信息如下表:
容器
起始物质的量/mol
CO2平衡转化率(α)
编号
容积/L
条件
CH4(g)
CO2(g)
CO(g)
H2(g)
Ⅰ
2
恒温恒容
2
1
0
0
50%
Ⅱ
1
0.5
1
0
0
Ⅲ
1
绝热恒容
1
0.5
0
0
-
下列说法正确的是
A.T K时,反应CH4(g)+CO2(g)⇌2CO(g)+2H2(g)的平衡常数为1/3
B.容器Ⅱ中反应达到平衡时,α(CO2,Ⅱ)=50%
C.容器Ⅲ中反应达到平衡时反应热在123.5—247 kJ·mol-1范围内
D.容器Ⅱ中反应达到平衡时,再投入0.5 mol CH4、0.25 mol CO,反应达到新平衡前,v(正)<v(逆)
难度: 中等查看答案及解析
-
根据下列图示所得出的结论正确的是
A.
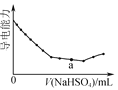 是Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液的导电能力随滴入NaHSO4溶液体积变化的曲线,说明a点对应的溶液呈碱性
是Ba(OH)2溶液中滴加NaHSO4溶液之后,溶液的导电能力随滴入NaHSO4溶液体积变化的曲线,说明a点对应的溶液呈碱性B.
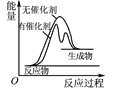 表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化C.
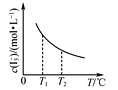 是I2+I-⇌I3-中I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)<K(T2)
是I2+I-⇌I3-中I3-的平衡浓度随温度变化的曲线,说明平衡常数K(T1)<K(T2)D.
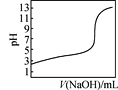 是室温下用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1某酸HX的滴定曲线,说明可用甲基橙判断该反应的终点
是室温下用0.1 mol·L-1 NaOH溶液滴定0.1 mol·L-1某酸HX的滴定曲线,说明可用甲基橙判断该反应的终点难度: 中等查看答案及解析
-
草酸(H2C2O4)是一种二元弱酸。常温下,向H2C2O4溶液中逐滴加入NaOH溶液,混合溶液中lgX[X为
或
]与pH的变化关系如图所示。下列说法一定正确的是
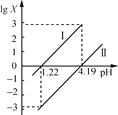
A.Ⅰ表示lg
与pH的变化关系
B.pH=1.22的溶液中:2c(C2O42—)+c(HC2O4—)>c(Na+)
C.1.22<pH<4.19的溶液中:c(HC2O4—)>c(C2O42—)>c(H2C2O4)
D.pH=4.19的溶液中:c(Na+)=3c(HC2O4—)
难度: 中等查看答案及解析
-
下列有关实验装置正确且能达到实验目的的是
A.
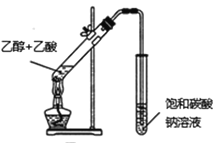 所示装置制取少量乙酸乙酯
所示装置制取少量乙酸乙酯B.
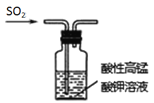 所示装置验证SO2的漂白性
所示装置验证SO2的漂白性C.
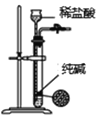 所示装置制取少量纯净的CO2气体
所示装置制取少量纯净的CO2气体D.
 所示装置分离水和苯
所示装置分离水和苯难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.向氨水中通入过量SO2:NH3·H2O+SO2===NH4++HSO3-
B.Si与NaOH溶液反应:Si+2OH-+H2O===SiO32-+H2↑
C.电解MgCl2溶液:2H2O+2Cl-
2OH-+H2↑+Cl2↑
D.Ba(OH)2溶液中滴入NaHSO4溶液至Ba2+恰好完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,且位于三个不同周期,X与W同主族,W元素金属性在短周期中最强,Z原子最外层电子数是其内层电子总数的3倍,Z原子的核电荷数等于X、Y原子核电荷数之和。下列说法正确的是
A.原子半径:r(W)>r(Z)>r(Y)>r(X)
B.元素Y的简单气态氢化物的热稳定性比Z的强
C.仅由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性也可能呈酸性
D.化合物X2Z2与W2Z2所含化学键类型完全相同
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.0.1 mol·L-1FeCl3溶液:Mg2+、Al3+、MnO4-、SCN-
B.能使紫色石蕊试液变蓝的溶液:Ca2+、Na+、ClO-、I-
C.0.1 mol·L-1 NH4HCO3溶液:Ba2+、K+、OH-、NO3—
D.
=10-12的溶液:NH4+、Na+、SO42-、Cl-
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
将适量苯加入溴水中,充分振荡后,水层接近无色
苯能与溴水发生加成反应
B
室温下,向FeCl3溶液中滴加少量KI溶液,再滴加2滴淀粉溶液,溶液变蓝色
Fe3+的氧化性比I2的强
C
室温下,向10 mL 0.2 mol·L-1 NaOH溶液中滴入2滴0.1 mol·L-1 MgCl2溶液,产生白色沉淀,再滴加2滴0.1 mol·L-1 FeCl3溶液,有红褐色沉淀生成
Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
D
常温下,分别测定浓度均为0.1 mol·L-1 NaF和NaClO溶液的pH,后者的pH大
酸性:HF<HClO
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
2019年4月22日是第50个“世界地球日”,我国确定的活动主题为“珍爱美丽地球,守护自然资源”。下列行为不符合这一活动主题的是( )
A. 改进汽车尾气净化技术,减少大气污染物的排放
B. 加快化石燃料的开采与使用,促进社会可持续发展
C. 用CO2合成聚碳酸酯可降解塑料,实现碳的循环利用
D. 对工业废水、生活污水进行净化处理,减少污染物的排放
难度: 简单查看答案及解析
-
有机物X的结构简式如图,某同学对其可能具有的化学性质进行了预测,其中正确的是
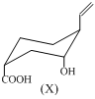
①可以使酸性KMnO4溶液褪色②可以和NaHCO3溶液反应③一定条件下能与H2发生加成反应④在浓硫酸、加热条件下,能与冰醋酸发生酯化反应
A.①② B.②③ C.①②③ D.①②③④
难度: 中等查看答案及解析
-
下列关于丙烯酸的说法不正确的是
A.与乙酸互为同系物 B.能与NaHCO3溶液反应
C.能与乙醇发生酯化反应 D.能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
下列有关有机化合物的说法正确的是
A.糖类、油脂、蛋白质都是仅由碳、氢、氧元素组成的物质
B.甲烷光照条件下能与Cl2发生加成反应
C.分枝酸的结构简式为
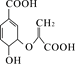 ,则其分子式为C10H10O6
,则其分子式为C10H10O6D.甲基环己烷的一氯代物有4种(不考虑立体异构)
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
B.反应 5NH4NO3
2HNO3+4N2↑ +9H2O 中,生成 28 g N2 时,转移的电子数目为3.75 NA
C.0.1 mo1·L-1 MgCl2溶液中含Cl-数为0.2NA
D.3.9 g Na2O2 晶体中含有的离子总数为0.2NA
难度: 中等查看答案及解析
-
一种“全氢电池”的工作原理如图所示。下列说法不正确的是
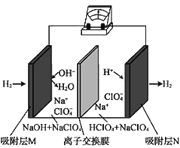
A.电子流向是从吸附层M通过导线到吸附层N
B.电池工作时,负极区pH减小
C.离子交换膜可用质子交换膜
D.负极的电极反应是:H2-2e-+2OH-=2H2O
难度: 中等查看答案及解析