-
化学与生产、生活、社会、环境密切相关,下列说法中正确的是
A.“滴水石穿、绳锯木断”一定不包含化学变化
B.食物中可加入适量的食品添加剂,如香肠中可以加少量的亚硝酸钠以保持肉质新鲜
C.明矾净水的原理和“84”消毒液消毒的原理相同
D.氯化钠注射液和淀粉的水溶液都能产生丁达尔现象
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法中正确的是
A.1 molNa与足量氧气反应转移电子数一定为NA
B.标准状况下,22.4 LCHCl3中含有的分子数为NA
C.1mol·L-1Na2CO3溶液中含有2NA个Na+
D.常温常压下,71g37Cl2含有NA个37Cl2分子
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,其中X、Y、Z在周期表中的相对位置如下图所示。Y是短周期主族元素中原子半径最大的元素,W的最高正化合价与最低负化合价的代数和为0,下列说法中不正确的是
X
Y
Z
A.W的氧化物可以用于制造太阳能电池
B.最高价氧化物对应水化物的碱性Y比X强
C.可以用电解法制备Z单质
D.Y和Z的最高价氧化物对应水化物之间可以相互反应
难度: 中等查看答案及解析
-
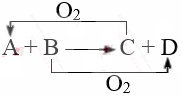
汽车安全气囊是汽车安全性辅助配置之一。汽车剧烈碰撞时,安全气囊中发生反应:10NaN3 + 2KNO3 == K2O + 5Na2O + 16N2↑,则下列判断不正确的是
A.NaN3是还原剂
B.N2既是氧化产物又是还原产物
C.氧化产物与还原产物物质的量之比为1:15
D.标准状况下,当有10mol电子转移时生成358.4L N2
难度: 中等查看答案及解析
-
类比归纳是学习化学的重要方法,对如下类比的说法正确的是
A.CO2、SO2都是酸性氧化物,都能使酸性高锰酸钾溶液褪色
B.MgO、Al2O3都是金属氧化物,它们都属于碱性氧化物
C.CO2与SiO2都是第IV A族的最高价氧化物,则它们的物理性质相似
D.Na2O与Na2O2都能与水反应,但反应实质不同
难度: 中等查看答案及解析
-
下列有关实验操作对应正确的是
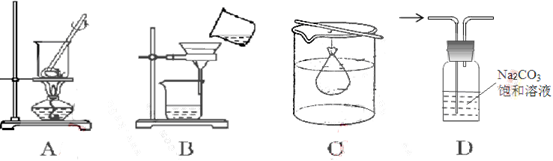
A.实验室灼烧胆矾测定胆矾中结晶水的含量
B.过滤除去粗盐中的沙子
C.除去Fe(OH)3胶体中的FeCl3
D.除去CO2中的HCl气体
难度: 中等查看答案及解析
-
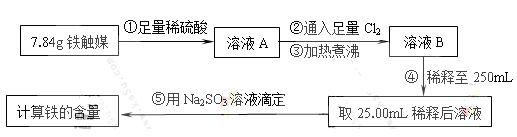
过量的硝酸和6.4g铜充分反应,向反应后的溶液中滴加5 mol·L-1的氢氧化钠溶液,加入氢氧化钠溶液的体积与生成沉淀的关系如图所示,则反应后溶液中所含NO3-的物质的量为
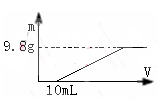
A.0.05mol B.0.1mol
C.0.2mol D.0.25mol
难度: 中等查看答案及解析