-
2017年11月5 日,长征三号乙运载火箭将两颗北斗三号全球导航卫星送入太空轨道。下列有关说法正确的是( )
A. 火箭燃料燃烧时将化学能转化为热能 B. 火箭燃料中的四氧化二氮属于化石燃料
C. 火箭箭体采用铝合金是为了美观耐用 D. 卫星计算机芯片使用的是高纯度的二氧化硅
难度: 中等查看答案及解析
-
下列实验操作正确的是( )
A.用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率
B.pH试纸使用时不需要润湿,红色石蕊试纸检测氨气时也不需要润湿
C.做过硫升华实验的试管用酒精洗涤
D.蒸馏操作时,装置中的温度计的水银球应位于蒸馏烧瓶中的液体中部
难度: 中等查看答案及解析
-
化学与我们的生活息息相关,下列说法正确的是( )
A.红宝石、玛瑙、水晶、钻石的主要成分都是硅酸盐
B.电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法
C.“霾尘积聚难见路人”,雾霾所形成的气溶胶没有丁达尔效应
D.鸟巢使用了高强度、高性能的钒氮合金高新钢,铁合金熔点、硬度均比纯铁高
难度: 简单查看答案及解析
-
下列有关从海带中提取碘的实验原理和装置能达到实验目的的是
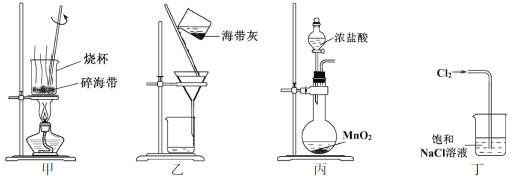
A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I−的Cl2
D. 用装置丁吸收氧化浸泡液中I−后的Cl2尾气
难度: 中等查看答案及解析
-
“绿色化学实验”进课堂,某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验。实验操作:钠与氯气反应的装置可作如图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( )
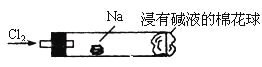
A.反应生成的大量白烟是氯化钠晶体
B.玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
C.钠着火燃烧产生苍白色火焰
D.若在棉球外沿滴一滴淀粉碘化钾溶液,可根据颜色变化判断氯气是否被碱液完全吸收
难度: 中等查看答案及解析
-
我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,该历程示意图如下所示。
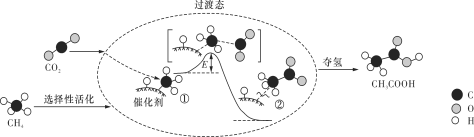
下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C—H键发生断裂
C. ①→②放出能量并形成了C—C键
D. 该催化剂可有效提高反应物的平衡转化率
难度: 中等查看答案及解析
-
氮化镁常用于制备其它超硬、高导热、耐高温的氮化物,实验室用以下装置制取氮化镁。已知:Mg+2NH3
Mg(NH2)2+H2,Mg3N2是一种浅黄色粉末,易水解。下列说法不正确的是
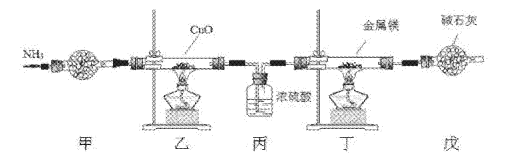
A. 实验开始时应先点燃乙处酒精灯,再点燃丁处酒精灯
B. 装置乙的目的是制备N2
C. 装置丙与装置戊可以对调
D. 取装置丁所得固体少许,滴入少量蒸馏水,可检验是否有Mg3N2
难度: 中等查看答案及解析
-
离子交换法净化水过程如图所示。下列说法中错误的是

A. 经过阳离子交换树脂后,水中阳离子的总数不变
B. 水中的
、
、Cl−通过阴离子树脂后被除去
C. 通过净化处理后,水的导电性降低
D. 阴离子树脂填充段存在反应H++OH−
H2O
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A. 常温常压下,124gP4中所含P—P键数目为4NA
B. 100mL1mol·L−1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA
难度: 中等查看答案及解析
-
我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na
2Na2CO3+C。下列说法错误的是( )
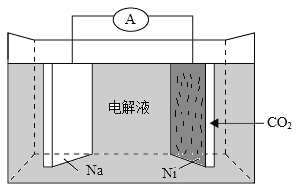
A.放电时,ClO4-向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为:3CO2+4e-=2CO32-+C
D.充电时,正极反应为:Na++e-=Na
难度: 中等查看答案及解析
-
利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
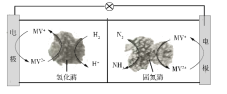
A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
难度: 中等查看答案及解析
-
H2CO3 Ka1=4.3×10-7 Ka2=5.61×10-11 HClO Ka=2.95×10-8 ,下列实验不能达到目的的是
选项
目的
实验
A
制取较高浓度的次氯酸溶液
将Cl2通入碳酸钠溶液中
B
加快氧气的生成速率
在过氧化氢溶液中加入少量MnO2
C
除去乙酸乙酯中的少量乙酸
加入饱和碳酸钠溶液洗涤、分液
D
制备少量二氧化硫气体
向饱和亚硫酸钠溶液中滴加浓硫酸
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
在容积可变的密闭容器中充入2mol A和1mol B发生反应:mA(g) + nB(g)
pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
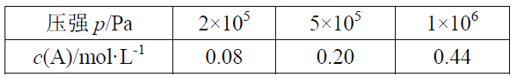
A.维持压强2×105Pa,若反应开始后5min时达到平衡,则v(A)=0.016mol/(L·min)
B.P从2×105Pa增加到5×105Pa时,平衡逆向移动
C.P为1×106Pa时,平衡常数表达式K=
D.其它条件相同时,在上述三个压强下分别发生该反应。A的转化率随时间变化曲线如图所示
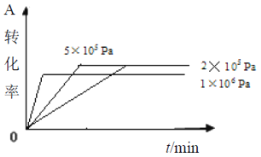
难度: 困难查看答案及解析
-
根据下列图示所得出的结论不正确的是
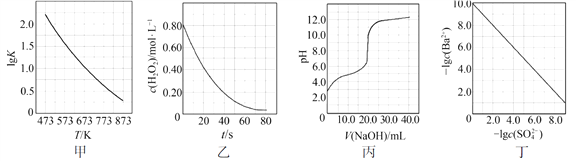
A.图甲是CO(g)+H2O(g)
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C.图丙是室温下用0.1000 mol·L−1NaOH溶液滴定20.00 mL 0.1000 mol·L−1某一元酸HX的滴定曲线,说明HX是一元强酸
D.图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42−)的关系曲线,说明溶液中c(SO42− )越大c(Ba2+ )越小
难度: 中等查看答案及解析
-
NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10−3 ,Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
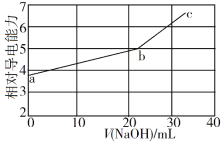
A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2−的导电能力之和大于HA−的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH−)
难度: 中等查看答案及解析
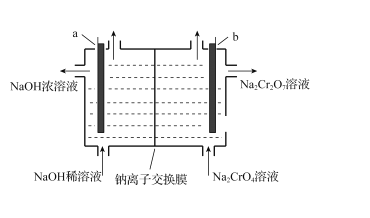
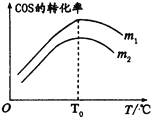 ①m1________m2(填>、<或=)。
①m1________m2(填>、<或=)。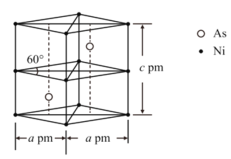 。
。