-
构成金属晶体的基本微粒是( )
A.分子 B.原子
C.阳离子与阴离子 D.阳离子与自由电子
难度: 简单查看答案及解析
-
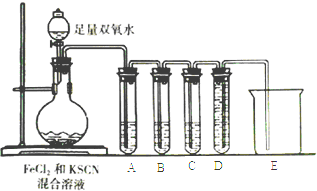
由铁、锌、镁、铝四种金属中的两种组成的10g混合物与足量的盐酸反应,反应后生成的氢气在标准状况下体积为11.2L.则混合物中一定含有的金属是( )
A.锌 B.铁 C.镁 D.铝
难度: 困难查看答案及解析
-
硬铝合金广泛用于现代社会.下列关于硬铝的说法中,错误的是( )
A.硬铝的密度约为钢材的三分之一,是适合于做飞行器的材料
B.硬铝的强度比铝大得多,铝材比钢材的某些性能要好
C.硬铝的熔点跟铝相比有一定的提高,常被用于炊具
D.硬铝的抗腐蚀性较强,常被用于制门窗框架
难度: 简单查看答案及解析
-
炼铁过程中的还原剂是( )
A.焦炭 B.空气 C.石灰石 D.一氧化碳
难度: 简单查看答案及解析
-
铝的某种超原子结构(Al13)具有40个价电子时最稳定。请预测稳定的Al13所带的电荷数为( )
A.+1 B.0 C.﹣1 D.﹣2
难度: 中等查看答案及解析
-
下列微粒中,最外层电子数最多的是( )
A.Ne B.Al3+ C.Fe D.Fe2+
难度: 简单查看答案及解析
-
某溶液中放入铝片可产生氢气,则在该溶液中一定能大量共存的一组离子是( )
A.Na+、Cl﹣、K+、SO42﹣ B.Fe3+、Al3+、SO42﹣、NH4+
C.NH4+、SO42﹣、Mg2+、Cl﹣ D.S2﹣、Na+、HCO3﹣、K+
难度: 中等查看答案及解析
-
等质量的稀硫酸分别与足量的镁、铁、锌三种金属(形状相同)反应,收集到氢气体积(V)与反应时间(t)的曲线,应该是下列图中的( )
A.
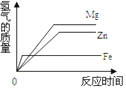 B.
B.
C.
 D.
D.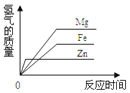
难度: 中等查看答案及解析
-
将一块镁铝合金溶于盐酸后,加入过量氢氧化钠溶液,过滤后灼烧沉淀物,所得白色粉末的质量等于原合金的质量,则该合金中镁铝的质量比是( )
A.3:2 B.2:3 C.1:1 D.2:1
难度: 困难查看答案及解析
-
将12g铁片放入150ml的CuSO4溶液中,当溶液中的Cu2+全部被还原时,铁片质量增加0.3g,则原CuSO4溶液的物质的量浓度是( )
A.0.125mol/L B.0.175mol/L
C.0.25mol/L D.0.50mol/L
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.FeCl2溶液中通入Cl2:Fe2++Cl2→Fe3++2Cl﹣
B.AlCl3溶液呈酸性:Al3++3H2O→Al(OH)3+3H+
C.Al2(SO4)3溶液加入过量的氨水:Al3++3 NH3•H2O→Al(OH)3↓+3NH4+
D.NaOH溶液中滴加少量Ca(HCO3)2溶液:Ca2++HCO3﹣+OH﹣→CaCO3↓+H2O
难度: 中等查看答案及解析
-
某混合溶液中含有MgCl2的浓度为2 mol·L-1,含AlCl3的浓度为3 mol·L-1,将此溶液200 mL中Mg2+转化为Mg(OH)2沉淀分离出来,至少需要1.6 mol·L-1的NaOH溶液的体积是( )
A. 3.2 L B. 2 L C. 1.5 L D. 1.8 L
难度: 中等查看答案及解析
-
某溶液pH=1,该溶液中可能含有Fe3+、NO3﹣、I﹣、Cl﹣中的一种或几种,向该溶液中滴入溴水,单质溴被还原,由此推断该溶液中( )
A.含Fe3+和NO3﹣,无I﹣和Cl﹣
B.含I﹣,不含Fe3+、NO3﹣,可能有Cl﹣
C.含NO3﹣,不含Fe3+、I﹣,可能有Cl﹣
D.含I﹣、Fe3+,不含Cl﹣,可能有NO3﹣
难度: 中等查看答案及解析
-
向一定量的铁、氧化亚铁和氧化铁的混合粉末中,加入100ml2mol/L的盐酸,恰好使混合物完全溶解,并放出448ml的气体(SPT),在所得溶液中加入KSCN溶液无血红色出现.若用相同质量的上述混合物粉末高温下同足量的一氧化碳反应,可得到铁的质量是( )
A.无法计算 B.2.8g C.5.6g D.11.2g
难度: 中等查看答案及解析
-
浅绿色的硝酸亚铁溶液存在如下平衡:Fe2++2H2O⇌Fe(OH)2+2H+,若在此溶液中加入盐酸,则溶液的颜色( )
A.变深 B.变浅 C.变黄 D.不变
难度: 中等查看答案及解析
-
等物质的量的Na和Al两种金属加入足量的水中,生成26.88L(标准状况下)的气体,则下列描述错误的是( )
A.金属 Al无剩余 B.c (Na+)=c(AlO2-)
C.所得溶液呈碱性 D.Na的物质的量是0.6mol
难度: 中等查看答案及解析
-
FeCl3、CuCl2的混合溶液中加入一定量的铁粉,充分反应后仍有固体存在,则下列判断不正确的是
A.剩余固体中一定不含Fe B.溶液中一定含Fe2+
C.加入KSCN溶液一定不变红色 D.溶液中一定不含Fe3+
难度: 中等查看答案及解析
-
下列类比关系正确的是 ( )。
A. AlCl3与过量NaOH溶液反应生成AlO2-,则与过量NH3·H2O也生成AlO2-
B. Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2
C. Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3
D. Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应
难度: 简单查看答案及解析