-
下列有关物质的分类,正确的是( )
A. 烧碱、纯碱、熟石灰均属于碱
B. HCOOH、H2CO3、H2SO4均属于二元酸
C. 盐酸、BaSO4、NH3•H2O均属于电解质
D. 酒精、冰水混合物、液氨均属于纯净物
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 有单质生成的反应一定是氧化还原反应
B. 非金属氧化物不一定是酸性氧化物
C. 金属氧化物一定是碱性氧化物
D. 纯净物只由一种原子组成,而混合物由多种原子组成
难度: 中等查看答案及解析
-
已知A、B都为短周期元素,且甲、乙、丙常温下都为气体(如图所示)。2 mol甲分子反应生成1 mol 丙和3 mol乙,下列对此判断不正确的是( )

A. 1个乙分子中含有2个A原子
B. 甲的摩尔质量为17 g·mol-1
C. 同温同压下,生成丙和乙的体积比为1∶3
D. 标准状况下,11.2 L甲溶于500 mL水中,所得溶液中甲的物质的量浓度为1 mol·L-1
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 容量瓶、分液漏斗、酸碱滴定管、冷凝管等仪器在使用前均需要检查是否漏液
B. 蒸发、蒸馏、配制标准物质的量浓度溶液均需要用到玻璃棒
C. 液溴保存:用带玻璃塞的细口棕色试剂瓶,液溴上加一层水,放在阴凉处
D. 烧瓶、量筒、容量瓶、滴定管洗净后均可放在烘箱中烘干
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 7.8 g Na2S和Na2O2的混合物中含有的阴离子数为NA
B. 17 g H2O2含有0.5NA个非极性共价键
C. 常温下,56 g铁片投入足量浓H2SO4中产生H2分子的个数为NA
D. 标准状况下,22.4LCl2溶于水转移的电子数为NA
难度: 中等查看答案及解析
-
下列化学反应的离子方程式书写正确的是( )
A. 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O
B. 用CH3COOH溶解CaCO3:CO32-+CH3COOH=CH3COO-+H2O+CO2↑
C. 强碱性溶液中NaClO将Fe(OH)3氧化为FeO42-: 3ClO-+2Fe(OH)3 +4OH-=2FeO42-+3Cl-+5H2O
D. NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化和杀毒
B. 胶体和溶液的本质区別是胶体能发生丁达尔效应,而溶液不能
C. 将外加直流电源通过Fe(OH)3胶体,电源负极附近颜色变深,则说明该胶体带正电荷
D. 利用渗析的方法可以将胶体和溶液进行分离
难度: 中等查看答案及解析
-
下列离子检验的方法正确的是( )
A. 向某无色溶液中加入BaCl2溶液,产生不溶于稀HNO3的白色沉淀,则原溶液中一定有SO42-
B. 向某无色溶液中加入盐酸,有无色、无味的气体产生,则说明原溶液中一定有CO32-
C. 向某无色溶液中加入氢氧化钠溶液并加热,产生无色气体,该气体可使蓝色石蕊试纸变红,则说明原溶液中一定有NH4+
D. 向某溶液中滴加硫氰化钾溶液溶液不变红,再滴加氯水溶液变红,说明原溶液一定有Fe2+
难度: 困难查看答案及解析
-
某同学购买了一瓶“84消毒液”,包装说明如下,请根据以上信息和相关知识判断,下列分析不正确的是( )

A. 该“84消毒液”的物质的量浓度约为4.0 mol·L-1
B. 一瓶该“84消毒液”敞口放置一段时间后浓度会变小
C. 取100 mL该“84消毒液”稀释100倍用以消毒,稀释后溶液中c(Na+)约为0.04mol·L-1
D. 参阅该“84消毒液”的配方,欲用NaClO固体配制含25%NaClO的消毒液480 mL,需要称量的NaClO固体质量为143 g
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. c(I-)=0.lmol·L-1的溶液中:Na+、Mg2+、Cl-、SO42-
B. pH< 7的溶液中:Fe2+、Na+、 Cl-、NO3-
C. 与Al反应能放出大量H2的溶液中: K+、NH4+、Ba2+、Cl-
D. 无色溶液中:K+、NH4+、MnO4-、SO42-
难度: 中等查看答案及解析
-
标准状况下,m g气体A与n g气体B的分子数目一样多,下列说法不正确的是( )
A. 在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m∶n
B. 25 ℃、1.25×105 Pa时,两气体的密度之比为n∶m
C. 同质量的A、B在非标准状况下,其分子数之比为n∶m
D. 相同状况下,同体积的气体A与B的质量之比为m∶n
难度: 困难查看答案及解析
-
下列关于误差分析的判断正确的是( )
A. 用浓硫酸配制稀硫酸时,量筒量取浓硫酸仰视会使所配溶液浓度偏高
B. 用托盘天平称取药品时药品和砝码位置颠倒药品质量一定偏小
C. 配制1 mol·L-1的NaOH溶液时未恢复至室温就转移并定容会使所得溶液浓度偏小
D. 用润湿的pH试纸测醋酸的pH会使测定结果偏小
难度: 中等查看答案及解析
-
某天然碱组成可表示为xNa2CO3·yNaHCO3·zH2O。取m g该天然碱配成1L溶液M。取出100mLM向其中加入50mL1 mol·L-1盐酸,两者恰好完全反应生成NaCl,同时产生CO2的体积为672mL(标准状况下),下列推断正确的是( )
A. m g该天然碱中含0.3molNa2CO3 B. m g该天然碱中含0.3molNa+
C. 溶液M中c(Na+)=0.5 mol·L-1 D. 该天然碱中x:y:z=2:1:2
难度: 困难查看答案及解析
-
下列除杂方案错误的是( )
选项
被提纯的物质
杂质
除杂试剂
除杂方法
A
C2H5OH
CH3COOH
生石灰
蒸馏
B
Cl2
HCl(g)
饱和食盐水、浓H2SO4
洗气
C
NH4Cl溶液
FeCl3
NaOH溶液
过滤
D
溴苯
Br2
NaOH溶液
振荡后分液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列装置能达到实验目的是
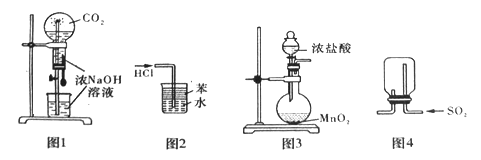
A. 利用图1装置进行喷泉实验 B. 利用图2装置吸收HCl气体,并防止倒吸
C. 利用图3装置制备C12 D. 利用图4装置收集SO2气体
难度: 简单查看答案及解析
-
某结晶水合物的化学式为A·H2O,其相对分子质量为B,在60℃时m g 该晶体溶于ng水中,得到V mL 密度为d g· mL-1 的饱和溶液,下述表达式或判断正确的是( )
A. 该溶液物质的量浓度为(m/BV)mol·L-1
B. 60℃时A 的溶解度为(100m(B-18)/nB)g
C. 该溶液溶质的质量分数为(m/(m+n))×100%
D. 60℃时,将10g A 投入到该饱和溶液中,析出的晶体质量大于10g
难度: 困难查看答案及解析
-
将mg镁铝合金投入到500 mL 2 mol/L的盐酸中,固体完全溶解,收集到气体5.6L (标准状况下)。向反应所得溶液中加入4mol/L的氢氧化钠溶液,沉淀达到最大值为13.60 g,则m的值为( )
A. 5.10 B. 8.50
C. 9.35 D. 11.48
难度: 困难查看答案及解析