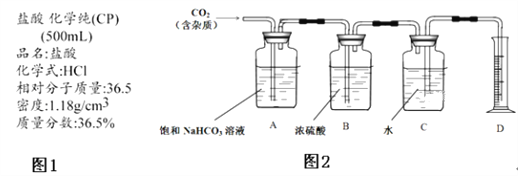
-
证明某溶液只含有Fe 2+而不含Fe 3+的实验方法是( )
A. 只需滴加KSCN溶液
B. 先滴加氯水,再滴加KSCN溶液后显红色
C. 先滴加KSCN溶液,不显红色,再滴加氯水后显红色
D. 滴加NaOH溶液,产生红褐色沉淀。
难度: 困难查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合 :4AlO2-+7H++H2O=3Al(OH)3↓+Al3+
B.硫酸氢钠溶液与氢氧化钡溶液混合显中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.稀硝酸中加入过量的铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O
D.向AlCl3溶液中加入过量氨水:Al3+ + 4 NH3·H2O=AlO2-+4NH4++2H2O
难度: 中等查看答案及解析
-
24mL 0.05mol/L 的Na2SO3溶液恰好与20mL 0.02mol/L的K2Cr2O7溶液完全反应;已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为
A.+2 B.+3 C.+4 D.+5
难度: 简单查看答案及解析
-
对于某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
难度: 简单查看答案及解析
-
下列化学物质在生活、生产的运用描述不正确的是
A. 氢氧化钠能与二氧化硅反应,故常用氢氧化钠在玻璃上进行刻画
B. 工业上常用氨气来检查氯气管道是否泄漏
C. 氧化铝俗名刚玉,耐磨,常用于做轴承材料
D. 钠和鉀的合金呈液态,常做核反应堆的导热剂
难度: 中等查看答案及解析
-
下列有关物质的分离和提纯的方法中正确的是
A.除去Cl2的HCl气体可以通过浓硫酸
B.碳酸钠固体中的碳酸氢钠杂质可以通过加热除去
C.SO2可以通过碱石灰干燥
D.FeCl3溶液中含有CuCl2可以加入足量NaOH溶液除去
难度: 中等查看答案及解析
-
下列离子方程式中,错误的是( )
A.在浓NaOH溶液中滴入几滴NH4Cl溶液:NH4+ + OH- = NH3↑ + H2O
B.铁与盐酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
C.将少量铜屑放入浓硝酸中:Cu + 4H+ + 2NO3- = Cu2+ + 2NO2↑+ 2H2O
D.氯气与烧碱溶液反应:Cl2 + 2OH- = Cl- + ClO- + H2O
难度: 中等查看答案及解析
-
下列关于氢氧化铁胶体的说法不正确的是:
A.往NaOH饱和溶液中滴加FeCl3饱和溶液,加热煮沸制备氢氧化铁胶体
B.氢氧化铁胶体的胶粒大小在1-100nm之间
C.氢氧化铁胶体可发生丁达尔效应
D.往氢氧化铁胶体中滴加电解质溶液可发生聚沉现象
难度: 中等查看答案及解析
-
下图所示的实验操作,能达到相应目的的是
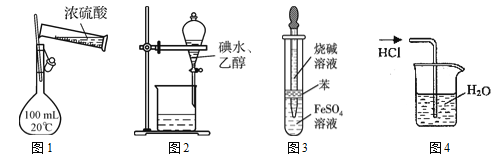
A. 用图1装置配制100 mL 0.1 mol·L-1硫酸
B. 用图2所示装置可萃取碘水中的碘
C. 用图3所示装置可制备氢氧化亚铁
D. 用图4所示装置可吸收HCl气体
难度: 中等查看答案及解析
-
下列实验的现象与对应结论均正确的是( )
选项
操作
现象
结论
A
在AlCl3溶液中滴加过量氨水
有白色沉淀生成
实验室常用此法制备Al(OH)3
B
常温下将Al片放入浓硝酸中
无明显变化
Al与浓硝酸不反应
C
取少量Fe(NO3)2试样加水溶解,加稀H2SO4酸化
滴加KSCN溶液,溶液变为红色
该Fe(NO3)2试样已经变质
D
将水蒸气通过灼热的铁粉
粉末变红
铁与水在高温下发生反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
向某无色溶液中分别进行下列操作,所得现象和结论正确的是
A.加入氨水,产生白色沉淀,证明原溶液中存在Al3+
B.加入AgNO3溶液,产生白色沉淀,证明原溶液中存在Cl-
C.加入盐酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中存在SO42-
D.加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中存在NH4+
难度: 中等查看答案及解析
-
如图装置,将溶液A逐渐加入固体B中,下列叙述中不正确的是( )
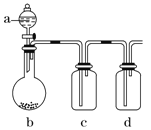
A.若a为浓硫酸,b为Na2SO3固体,c中盛石蕊溶液,则c中溶液先变红后褪色
B.若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液不褪色
C.若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊
D.若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀
难度: 中等查看答案及解析
-
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系如图所示。则甲和X不可能是

A.甲为C,X为O2
B.甲为SO2,X为NaOH溶液
C.甲为Fe,X为Cl2
D.甲为AlCl3溶液,X为NaOH溶液
难度: 中等查看答案及解析
-
向只含有Fe3+、Cu2+、H+各0.1mol及a mol SO42-的某溶液中加入足量锌粉,搅拌使其充分反应,下列说法中正确的是( )
A.当消耗13克Zn时, 得到的还原产物为0.25mol
B.当溶液中不再产生气泡时,溶液中大量存在的阳离子只有Zn2+
C.反应中最多有两种单质生成
D.反应结束时,可得到0.25molZnSO4
难度: 中等查看答案及解析
-
将一定量的氯气通入30 mL浓度为10.00 mol·L-1的氢氧化钠溶液中,加热一段时间后,溶液中形成NaCl、NaClO、NaClO3的共存体系。下列判断正确的是
A.与NaOH反应的氯气一定为0.3 mol
B.若反应中转移的电子为n mol,则0.15<n<0.25
C.n(Na+)∶n(Cl-)可能为7∶3
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为8∶2∶1
难度: 中等查看答案及解析
-
有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于某一反应中的反应物和生成物。下列叙述不正确的是( )
A.该反应一定为氧化还原反应
B.若NH4+为产物,则Fe3+也是产物
C.该反应过程中,溶液的pH不断增大
D.该反应的离子方程式中,Fe2+、NH4+两者计量数之比为1︰8
难度: 中等查看答案及解析
-
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释正确的是
现象
解释
A
用洁净的铂丝蘸取某溶液进行焰色反应,火焰呈黄色
该溶液中一定含有Na+,一定无K+
B
SO2能使酸性高锰酸钾溶液褪色
SO2具有漂白性
C
某溶液中先加入稀盐酸无现象,再加入氯化钡溶液,有白色沉淀生成
该溶液中一定含有SO42﹣
D
铁加入稀硝酸中有气泡产生
铁与稀硝酸发生了置换反应
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
NA表示阿伏加德罗常数,下列说法正确的是
A.2 mol·L-1的Na2SO4溶液中含有4 NA个Na+
B.将含有0.1 mol FeCl3的饱和溶液逐滴滴入足量沸水中,得到Fe(OH)3胶体数目为0.1 NA
C.在标准状况下,11.2 L氖气中含有NA个氖原子
D.7.8 g Na2O2中阴离子数目为0.1NA
难度: 中等查看答案及解析
-
下列对有关实验描述和解释正确的是
A. SO2气体通入酸性高锰酸钾溶液中,使高锰酸钾褪色说明SO2有漂白性
B. 浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸
C. 常温下,将铝、铁片放入浓硫酸、浓硝酸中,无明显现象,说明铝、铁不与冷的浓硫酸、浓硝酸反应
D. 向CuSO4溶液中加入一小块金属钠,则钠与Cu2+反应可置换出铜
难度: 困难查看答案及解析
-
把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A.(
-
) mol/L B.(2b-a) mol/L
C.(5b-
) mol/L D.(10b-5a) mol/L
难度: 中等查看答案及解析