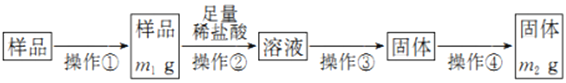
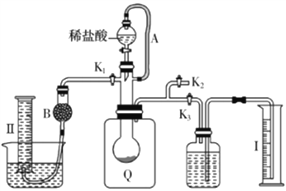
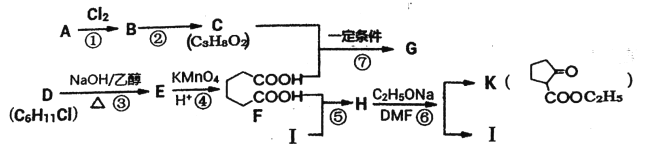
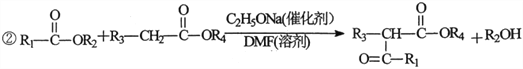
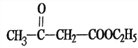-
以下是中华民族为人类文明进步做出巨大贡献的几个事例,运用化学知识对其进行的分析不合理的是
A. 四千余年前用谷物酿造出酒和醋,酿造过程中只发生水解反应
B. 商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品
C. 汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏士
D. 屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是( )
A.CH4和Cl2按体积比1∶3混合可制得纯净的CHCl3
B.人体内的蛋白质分解,最终生成二氧化碳和水排出体外
C.C3H6O2有3种同分异构体,它们均能与钠反应放出氢气
D.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别
难度: 中等查看答案及解析
-
短周期主族元素a、b、c、d的原子序数依次增大。四种元素形成的单质依次为m、n、p、q ;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃时,0.01mol·L-1w溶液中,c(H+)/c(OH-)=1.0×10-10。上述物质的转化关系如图所示。下列说法正确的是
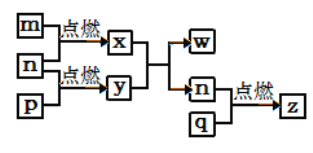
A.原子半径的大小:a<b<c<d
B.氢化物的沸点:b>d
C.x的电子式为:
D.y、w含有的化学键类型完全相同
难度: 中等查看答案及解析
-
下列实验操作、现象与结论对应关系正确的是( )
选项
实验操作
实验现象
结论
A
取适量Na2SO3固体于试管中,加水溶解,加入Ba(NO3)2溶液,再加入稀硝酸
先有白色沉淀,加入稀硝酸后沉淀不溶解
Na2SO3固体已变质
B
将乙烯通入酸性KMnO4溶液中
紫红色褪去
乙烯具有漂白性
C
加热某盐与NaOH的混合溶液,用湿润的红色石蕊试纸检验产生的气体
红色石蕊试纸变蓝
该盐为铵盐
D
向大理石固体中滴加稀盐酸
产生气泡
Cl非金属性强于C
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.在18 g CD4中含有NA个碳原子
B.某无水乙醇与足量金属钠反应生成5.6LH2,该乙醇分子中共价键总数为4NA
C.4.4g乙醛和丁酸的混合物完全燃烧,消耗氧分子的数目为0.25NA
D.100mL浓度为lmol/L的蔗糖溶液中所含分子数为0.1NA
难度: 中等查看答案及解析
-
利用如图所示装置,可以模拟铁的电化学防护。下列说法错误的是( )
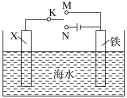
A.若X是锌棒,将K与M连接,此方法是牺牲阳极的阴极保护法,使铁不易受腐蚀
B.若X是碳棒,将K与N连接,可减缓铁的腐蚀
C.若X是碳棒,将K与M连接,碳棒的电极反应式是2H++2e-=H2↑
D.若X是锌棒,将K与N连接,锌棒的电极反应式是Zn-2e-=Zn2+
难度: 中等查看答案及解析
-
常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸体积关系如右图所示。下列有关叙述错误的是
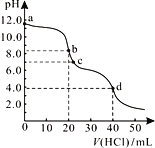
A. a点溶液呈碱性的原因用离子方程式表示为:CO32-+H2O
HCO3-+OH-
B. b点处的溶液中c(Na+)-2c(CO32-)=c(HCO3-)+c(Cl-)
C. 滴定过程中使用酚酞作为指示剂比石蕊更准确
D. d点处溶液中水电离出的c(H+)小于c点处
难度: 困难查看答案及解析