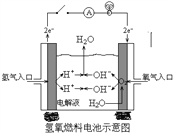
-
下列说法或表示法正确的是( )
A.等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(石墨)→C(金刚石)ΔH = +1.9kJ/mol可知,金刚石比石墨稳定
C.在稀溶液中:H++OH﹣=H2O ΔH=﹣57.3kJ/mol,若将含1molCH3COOH的醋酸溶液与含1molNaOH的溶液混合,放出的热量小于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) ΔH= +285.8 kJ/mol
难度: 简单查看答案及解析
-
某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是( )
A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和
难度: 中等查看答案及解析
-
化学与生活密切联系,下列与盐类水解无关的是( )
A.用NaHCO3粉末作灭火剂
B.实验室盛放Na2SiO3溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
C.实验室配制FeCl3溶液时,应先将其溶解在盐酸中,而后加水稀释
D.加热蒸干A1C13溶液得到A1(OH)3固体
难度: 中等查看答案及解析
-
一种海水电池的反应原理可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,有关反应的说法正确的是
A. 反应中MnO2是还原剂
B. 电池工作时,海水起导电作用,其中NaCl浓度保持不变
C. Ag为负极,电极反应为Ag-e-+Cl-=AgCl
D. 每生成1 mol Na2Mn5Ol0转移1mol电子
难度: 中等查看答案及解析
-
0.1mol/LNH4Cl溶液中离子浓度大小顺序正确的是( )
A. c(Cl-)>c(NH4+)>c(H+)>c(OH-) B. c(NH4+) >c(Cl-)>c(H+)>c(OH-)
C. c(Cl-)>c(NH4+)>c(OH-)>c(H+) D. c(NH4+)>c(Cl-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
反应A(g)+B(g)
C(g) +D(g) 发生过程中的能量变化如图,△H 表示反应的焓变。下列说法正确的是( )

A.反应体系中加入催化剂,反应速率增大,E1减小,E2增大
B.反应体系中加入催化剂,反应速率增大,△H增大
C.△H < 0,反应达到平衡时,升高温度,A的转化率减少
D.△H > 0,反应达到平衡时,增大压强,A的转化率不变
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.CH3Cl(g)+Cl2(g)= CH2Cl2(1) +HCl(g)能自发进行,则该反应的△H>0
B.在向含有BaSO4沉淀的溶液中加入Na2SO4 固体,c (Ba2+) 增大
C.加热0.1mol/LNa2CO3溶液,CO32- 的水解程度和溶液的pH 均增大
D.对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
难度: 中等查看答案及解析
-
水的电离平衡曲线如右图所示,下列说法中,正确的是

A.图中A、B、D三点处KW间的关系: B>A>D
B.100℃,向pH=2的稀硫酸中逐滴加入等体积pH=10的稀氨水,溶液中 c(NH4+)/c(NH3·H2O)减小,充分反应后,溶液到达B点
C.温度不变,在水中加入适量NH4Cl固体,可从A点变化到C点
D.加热浓缩A点所示溶液,可从A点变化到B点
难度: 中等查看答案及解析
-
有关热化学方程式书写与对应表述均正确的是( )
A.稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l)△H = +57.3 kJ·mol-1
B.在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1
C.已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的燃烧热大于110.5 kJ·mol-1
D.2N2O5(g)
4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
难度: 中等查看答案及解析
-
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
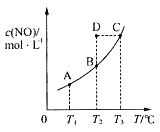
A.该反应的ΔH>0
B.若该反应在T1、T2℃时的平衡常数分别为K1、K2,则K1<K2
C.在T2℃时,若反应体系处于状态D,则此时v正>v逆
D.若状态B、C、D的压强分别为p(B)、p(C)、p(D),则p(C)=p(D)>p(B)
难度: 中等查看答案及解析
-
25 ℃时,几种弱酸的电离常数如下:
弱酸的化学式
CH3COOH
HCN
H2S
电离常数(25 ℃)
1.8×10-5
4.9×10-10
K1=1.3×10-7
K2=7.1×10-15
25 ℃时,下列说法正确的是
A.等物质的量浓度的各溶液的pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度的HCN溶液的pH=d,则其中c(OH-)=10-d mol/L
难度: 困难查看答案及解析
-
用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是 ( )
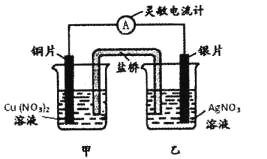
A.电子通过盐桥从乙池流向甲池
B.铜导线替换盐桥,原电池仍继续工作
C.开始时,银片上发生的反应是:Ag—e=Ag+
D.将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同
难度: 中等查看答案及解析
-
25℃时,水的电离可达到平衡:H2O
H++OH- ΔH>0。下列叙述正确的是
A.向水中加入稀醋酸,平衡逆向移动,c(OH-)升高
B.将水加热,Kw增大,pH不变
C.向水中加入少量NH4Cl固体,平衡逆向移动,c (H+)增大
D.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
难度: 简单查看答案及解析
-
500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为2 mol·L-1 B.上述电解过程中共转移2 mol电子
C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为2 mol·L-1
难度: 中等查看答案及解析
-
下列由实验现象得出的结论正确的是( )
操作及现象
结论
A
室温下,向1 mL 0.1mol/L AgNO3溶液中加入几滴0.01mol/L NaCl溶液出现白色沉淀,再滴加几滴0.1mol/L NaI溶液,出现黄色沉淀。
Ksp(AgI)< Ksp(AgCl)
B
在醋酸钠溶液中滴入酚酞试液,加热后红色加深
盐类水解是吸热反应
C
向某溶液中滴加氯水后再加入KSCN溶液,溶液变红
溶液中一定含有Fe2+
D
将FeCl3饱和溶液滴加到NaOH溶液中
可以制得Fe(OH)3胶体
A. A B. B C. C D. D
难度: 中等查看答案及解析