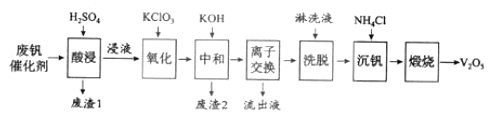
-
O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A.氧气是氧化产物
B.O2F2既是氧化剂又是还原剂
C.若生成4.48 L HF,则转移0.8 mol电子
D.还原剂与氧化剂的物质的量之比为1:4
难度: 中等查看答案及解析
-
化学与生活密切相关。下列说法错误的是 ( )
A.用石灰、碳酸钠等碱性物质处理废水中的酸
B.氯气可用于自来水杀菌消毒
C.氢氧化铝可用于中和过多胃酸
D.用谷物酿造出酒和醋,酿造过程中只发生水解反应
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A.中子数为8 的氮原子:
B.氟离子的结构示意图:
C.CaCl2的电子式:
D.HCl 的电子式:
难度: 简单查看答案及解析
-
阿伏加德罗常数的值为NA。下列说法正确的是( )
A.1 L 0.1 mol·
NH4Cl溶液中,NH4+的数量为0.1NA
B.2.4g镁在足量的O2中燃烧,转移的电子数为0.1NA
C.标准状况下,5.6 L CO2气体中含有的氧原子数为0.5NA
D.1 mol N2与3 mol H2反应生成的NH3分子数为2NA
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是 ( )
A.碱性溶液中:Ba2+、K+、CH3COO−、NO3−
B.无色透明的溶液中:Fe3+、Mg2+、SCN–、Cl–
C.0.1 mol·L−1KI 溶液:Na+、K+、ClO− 、OH−
D.酸性溶液中:Na+、NH4+、
、HCO3-
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是 ( )
A.钠与水反应:Na +2H2O
Na++2OH– + H2↑
B.将铜插入稀硝酸中:Cu+4H++2NO3–===Cu2++2NO2↑+H2O
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
D.向氢氧化钡溶液中加入稀硫酸:Ba2++OH– + H+ +
BaSO4↓+H2O
难度: 中等查看答案及解析
-
下列变化中,气体被还原的是 ( )
A.二氧化硫使酸性高锰酸钾溶液褪色 B.氯气使KBr溶液变黄
C.二氧化碳使Na2O2固体变白 D.氨气使MgCl2溶液产生白色沉淀
难度: 简单查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是 ( )
A.Fe
FeCl2
Fe(OH)2
B.S
SO3
H2SO4
C.CaCO3
CaO
CaSiO3
D.NH3
NO
HNO3
难度: 简单查看答案及解析
-
短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法不正确的是( )
A.原子半径:r(W)〈r(Z) 〈 r(Y)
B.由X、Y 组成的化合物中一定含有离子键
C.Y 的最高价氧化物的水化物的碱性比Z的强
D.X 的简单气态氢化物的热稳定性比W的弱
难度: 简单查看答案及解析
-
根据下列实验操作和现象得出的结论正确的是 ( )
选项
实验操作
现象
结论
A
将某溶液与稀盐酸反应产生的气体通入澄清石灰水
石灰水变浑浊
该溶液中不一定含有CO32-
B
常温下,将铁片浸入足量浓硫酸中
铁片不溶解
常温下,铁与浓硫酸一定没有发生化学反应
C
向某食盐溶液中滴加淀粉溶液
溶液颜色不变
该食盐中一定没有添加KIO3
D
①某溶液中加入Ba(NO3)2溶液
②再加足量盐酸
①产生白色沉淀
②仍有白色沉淀
原溶液中有SO42-
A.A B.B C.C D.D
难度: 中等查看答案及解析