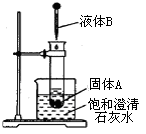
-
下列物质中,属于新型无机非金属材料的是( )
A. 有色玻璃 B. 碳化硅陶瓷 C. 石英玻璃 D. 钢化玻璃
难度: 简单查看答案及解析
-
实验室中,要使AlCl3溶液中的Al3+全部沉淀出来,最适宜选用的试剂是( )
A.NaOH溶液 B.Ba(OH)2溶液 C.盐酸 D.氨水
难度: 简单查看答案及解析
-
下列关于SiO2的说法中错误的是( )
A. SiO2不与任何酸反应 B. SiO2可与HF反应而被腐蚀
C. 石英、水晶、玛瑙的主要成分都是SiO2 D. 自然界中SiO2主要存在于石英矿和沙石中
难度: 简单查看答案及解析
-
下列物质中,既可与盐酸反应,又可与氢氧化钠溶液反应的是( )
①Na2SiO3 ②AlCl3 ③NH4HCO3 ④Al2O3 ⑤NaHSO4
A.③④ B.①④⑤
C.②③ D.②④
难度: 简单查看答案及解析
-
下列各组离子在指定溶液中,一定能大量共存的是( )
A. 无色溶液中:[Al(OH)4]-、K+、OH-、NO
B. 能与铝片反应产生氢气的溶液中:Al3+、Cl-、Fe2+、NO
C. 常温下,pH=2的溶液中:SO
、Cl-、K+、SiO
D. 含有较多Fe3+的溶液中:Na+、SO
、SCN-、I-
难度: 中等查看答案及解析
-
下列反应的离子方程式不正确的是( )
A. 石英与烧碱溶液共热:SiO2+2OH-
SiO
+H2O
B. 在氯化铝溶液中滴加过量的氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH
C. 在氢氧化钠溶液中通入少量的CO2:2OH-+CO2===CO
+H2O
D. 用NaOH溶液溶解Al2O3:Al2O3+6OH-===2[Al(OH)4]-+H2O
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
①质子数相同的微粒一定属于同种元素
②同位素的性质几乎完全相同
③质子数相同、电子数也相同的微粒,不可能是一种分子和一种离子
④电子数相同的微粒不一定是同一种元素
⑤一种元素只能有一种质量数
⑥某种元素的相对原子质量取整数就是其质量数
A. ①②④⑤ B. ③④⑤⑥ C. ②③⑤⑥ D. ①②⑤⑥
难度: 中等查看答案及解析
-
有aXn+和bYm-两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是( )
A. a-n=b+m B. 氢化物HaX或XHa C. a+n=b-m D. 化合物YnHm
难度: 中等查看答案及解析
-
已知mRn-阴离子的原子核内有x个中子,W g mRn-阴离子含有的电子的物质的量为( )
A. (m-x)n B. W(m-x-n)n C.
(m-x+n) D.
难度: 困难查看答案及解析
-
下列关于元素性质和结构的递变情况的说法错误的是( )
A. Li、Be、B原子最外层电子数依次增多
B. P、S、Cl元素最高正价依次升高
C. N、O、F原子半径依次增大
D. Na、K、Rb的电子层数逐渐增多
难度: 中等查看答案及解析
-
下列有关原子结构和元素周期律的表述正确的是( )
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族
A. ①② B. ①③ C. ②④ D. ③④
难度: 中等查看答案及解析
-
下列关于同主族元素的说法中错误的是( )
A. 同主族元素随原子序数递增,元素原子失电子能力逐渐增强
B. 同主族元素随原子序数递增,单质氧化性逐渐增强
C. 同主族元素原子最外层电子数都相同
D. 同主族元素的原子半径,随原子序数增大而逐渐增大
难度: 中等查看答案及解析
-
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
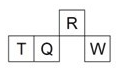
A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. T的最高价氧化物对应的水化物不能和强碱反应
难度: 中等查看答案及解析
-
在一定温度下
,向a L密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)
3Z(g)。此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为l∶2∶3
D.单位时间消耗0.1 mol X同时生成0.3 mol Z
难度: 中等查看答案及解析
-
下列关于化学反应限度的说法正确的是( )
A.当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度
B.当一个可逆反应进行到平衡状态时,这个反应的正向反应速率和逆向反应速率相等
C.平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变
D.化学反应的限度不可以通过改变条件而改变
难度: 中等查看答案及解析
-
氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol 氢气中的化学键消耗的能量为Q1 kJ,破坏1 mol 氯气中的化学键消耗的能量为Q2 kJ,形成1 mol 氯化氢中的化学键释放的能量为Q3 kJ。下列关系式中,正确的是
A.Q1+Q2>Q3 B.Q1+Q2>2Q3 C.Q1+Q2<Q3 D.Q1+Q2<2Q3
难度: 困难查看答案及解析
-
下列说法中错误的是( )
A. 化学反应中的能量变化通常表现为热量的变化
B. 需要加热才能发生的反应一定是吸热反应
C. 化学键的断裂和形成是化学反应中能量变化的主要原因
D. 反应物总能量和生成物总能量的相对大小决定了反应是放热还是吸热
难度: 简单查看答案及解析
-
下列有关玻璃的说法不正确的是( )
A. 制普通玻璃的原料主要是纯碱、石灰石和石英
B. 普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅
C. 玻璃在加热熔化时有固定的熔点
D. 盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅反应生成硅酸钠而使瓶塞与瓶口黏在一起
难度: 简单查看答案及解析
-
下列各组化合物中,化学键类型完全相同的时( )
A.CaCl2 和 Na2S B.Na2O 和Na2O2
C.CO2 和 CaO D.HCl 和NaOH
难度: 中等查看答案及解析
-
下列关于碱金属元素和卤素的说法中,错误的是( )
A. 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大
B. 碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强
C. 钾与水的反应比钠与水的反应剧烈
D. 溴单质与水的反应比氯单质与水的反应更剧烈
难度: 中等查看答案及解析
-
下列说法正确的( )
A. 含有共价键的化合物一定是共价化合物 B. 分子中只有共价键的化合物一定是共价化合物 C. 离子化合物中只能含离子键 D. 只有非金属原子间才能形成共价键
难度: 中等查看答案及解析
-
在温度不变的条件下,在恒容的容器中进行下列反应:2NO2
N2O4。若
的浓度由
降到
需要15s,那么
的浓度由
降到
所需的反应时间( )
A. 等于5s B. 等于10s C. 大于10s D. 小于10s
难度: 简单查看答案及解析
-
为了及时处理镉污染事件污染带来的危害,往江水里投放烧碱或石灰,使水呈碱性,生成氢氧化镉从而减轻污染。镉(Cd)是一种重金属元素,有多种核素。下列关于
和
的说法正确的是( )
A.
和
都含有48个中子 B.
和
互为同位素
C.
和
的核外电子数不同 D.
和
分别含有60和62个质子
难度: 简单查看答案及解析
-
已知1~18号元素的离子cY2-、bX+、aW2+、dZ-都具有相同的电子层结构,下列关系正确的是( )
A. 质子数:c > d B. 原子半径:X<W
C. 氢化物的稳定性:H2Y>HZ D. 离子的还原性:Y2->Z-
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大。W原子是半径最小的原子,非金属元素X形成的一种单质能导电,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
B.元素X与W形成的共价化合物有很多种
C.元素W、X的氯化物中,各原子均满足8电子的稳定结构
D.元素Z可与元素X形成共价化合物XZ2
难度: 困难查看答案及解析