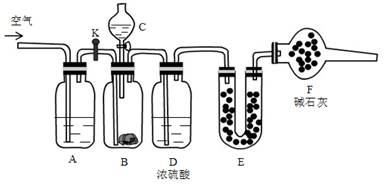
-
下列说法正确的是
A.纳米材料微粒的直径在1~100nm,因此纳米材料属于胶体
B. 溶液呈电中性,胶体带有电荷
C.可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人体健康危害极大
D.FeCl3溶液与Fe(OH)3胶体的本质区别是有无丁达尔效应
难度: 简单查看答案及解析
-
用氢氧化钠固体配制480mL 0.1mol/LNaOH溶液时,下列有关说法错误的是
A.用到的玻璃仪器有:玻璃棒、胶头滴管、容量瓶、量筒、烧杯
B.洗净的容量瓶必须干燥后,才能用
C.称量2 g氢氧化钠固体
D.没有等溶液冷却就转移,或定容时俯视,均导致所配溶液浓度偏高
难度: 简单查看答案及解析
-
如图所示是两个甲分子发生反应生成丙分子和乙分子的过程,则下列判断正确的是

A.该反应为置换反应 B.一个丙分子内有两对共用电子对
C.乙分子中存在非极性键 D.乙的摩尔质量=2倍甲的摩尔质量-丙的摩尔质量
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的数值,则下列说法中正确的是
①2.24L氨气含有NA个电子,②1.4g乙烯与丙烯的混合气体含有NA个碳原子,③精炼铜, 若阳极失去2NA个电子,则阴极增重64g,④标准状况下,22.4L空气含有NA个分子,⑤ 过氧化钠与水反应,若电子转移4NA,则产生的氧气为32 g,⑥将1L 2mol/L 的FeCl3溶液 加入到沸水中,加热使之完全反应,所得氢氧化铁胶体粒子数为2NA,⑦在1L 0.1mol/L的碳酸钠溶液中,阴离子总数大于0.1NA
A. ②③④⑦ B. ①③④⑦ C. ②③④⑤⑦ D. ②④⑤⑦
难度: 简单查看答案及解析
-
已知一个12C的质量为 a g,一个18O的质量为b g,阿伏伽德罗常数的数值为NA,则下列说法中不正确的是
A.18O的摩尔质量为:bNA g/mol B.氧元素的相对原子质量:
C. m g该氧原子的物质的量为:
mol D.a=
难度: 简单查看答案及解析
-
如图所示等质量C2H6与X气体在相同温度下的密闭容器中,压强(P)与体积(V)的关系,则X气体可能是
A.H2 B.NO C.C2H2 D.HCl
难度: 简单查看答案及解析
-
已知向某溶液中逐滴加入NaOH溶液时,测得生成沉淀的质量随所加入NaOH的体积变化如图所示,则该溶液中大量含有的离子可能是

A.H+、NH4+、Al3+、NO3- B.H+、Al3+、AlO2-、SO42-
C.H+、NH4+、Mg2+、Cl- D.NH4+、Al3+、Cl-、SO42-
难度: 简单查看答案及解析
-
向含下列离子的各组溶液中,分别加入Na2O2后,还能大量共存的一组是
A.NH4+、Ca2+、NO3-、Cl- B.K+、Mg2+、HCO3-、MnO4-
C.Na+、Ba2+、Cl-、I- D.K+、Na+、CO32-、SO42-
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.向NH4HSO3溶液中,加入过量的氢氧化钠溶液,并加热 NH4++OH-
NH3↑+H2O
B.向FeBr2溶液中通入过量氯气 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C.向次氯酸钠溶液中通入少量SO2气体 2ClO- + SO2 + H2O = 2HClO + SO32-
D.实验室制氯气 MnO2 + 4H+ + 2Cl-
Mn2+ + Cl2 ↑+2 H2O
难度: 简单查看答案及解析
-
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
(1)4FeO·Cr2O3 + 8Na2CO3 + 7O2
8Na2CrO4 + 2Fe2O3 + 8CO2
(2)2Na2CrO4 + H2SO4
Na2SO4 + Na2Cr2O7 + H2O
下列说法正确的是
A.反应(1)和(2)均为氧化还原反应
B.反应(1)的氧化剂是O2,还原剂是FeO·Cr2O3
C.高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4
D.反应(1)中每生成1molNa2CrO4时电子转移3mol
难度: 简单查看答案及解析
-
由下列反应得出的结论中正确的是
A.MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O 还原性由强到弱:HCl(浓)>MnCl2
B.H2S + CuSO4 = CuS↓+ H2SO4 酸性由强到弱:H2S>H2SO4
C.2KClO3+I2=2KIO3+Cl2 非金属性由强到弱:I>Cl
D.NaAlO2 + NaHCO3 + H2O = Al(OH)3 ↓+ Na2CO3 电离由易到难:Al(OH)3>HCO3-
难度: 简单查看答案及解析
-
某温度下,饱和石灰水的溶解度为s g ,密度为 ρg/mL,向足量该饱和溶液中加入 m g CaO,充分作用后,恢复到原来温度,下列有关说法不正确的是
A.最终得到沉淀的质量大于
B.该饱和溶液质量百分比浓度为:
C.最终所得溶液PH不变
D.该饱和溶液中溶质物质的量浓度为:
mol/L
难度: 简单查看答案及解析
-
下列反应能用:H++OH-=H2O表示的是
A.盐酸溶液与氨水混合 B.NaHSO4溶液与Ba(OH)2溶液混合
C.NaHCO3溶液与NaOH溶液混合 D.Ca(OH)2溶液与硝酸溶液混合
难度: 简单查看答案及解析
-
如图所示,两圆圈相交的阴影部分表示圆圈内的物质相互发生的反应。已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g。下列说法正确的是

A.Na2O2中阴阳离子数目之比为1:1
B.反应①的离子方程式为:Na + 2H2O =Na+ + 2OH- + H2↑
C.反应③最多能产生0.05mol O2
D.①、②、③充分反应后所得溶液的质量分数从大到小:①>②>③
难度: 简单查看答案及解析
-
某溶液中所含离子及其浓度如下表,则Mn+及a值可能为
所含离子
NO3-
SO42-
H+
Na+
Mn+
浓度(mol/L)
3
1
2
1
A
A.Mg2+、1 B.Ba2+、0.5 C.Al3+、1.5 D.Fe2+、 2
难度: 简单查看答案及解析
-
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数之比为2:3:3,向溶液中通入氯气,使溶液中Cl-和Br-的个数比为7:3,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为(已知还原性I->Fe2+>Br->Cl-)
A.5:4 B.4:5 C.5:12 D.12:5
难度: 简单查看答案及解析