-
能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源,需依靠其他能源间接制取的能源为二级能源。据此判断,下列叙述不正确的是( )
A.潮汐能是一级能源 B.太阳能是一级能源
C.风能是一级能源 D.电能是一级能源
难度: 简单查看答案及解析
-
2019年科幻片《流浪地球》中有个画面,冰原上是身穿“核电池全密封加热服”的人类,一旦被卸下核电池,人类就被冻僵,该装置提供电能,并将电能转化为 ( )
A.化学能 B.热能 C.生物质能 D.动能
难度: 简单查看答案及解析
-
决定化学反应速率快慢的主要因素是( )
A.参加反应物质的本身性质 B.催化剂
C.浓度和压强 D.温度
难度: 简单查看答案及解析
-
下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀硫酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在O2中的燃烧反应
难度: 中等查看答案及解析
-
下列热化学方程式能表示可燃物燃烧热的是( )
A.2H2(g)+O2(g)=2H2O(l) △H=-570.6kJ·mol-1
B.CH4(g)+2O2(g)=2H2O(l)+CO2(g) △H=-802.3kJ·mol-1
C.2CO(g)+ O2(g)=2CO2(g) △H=-566kJ·mol-1
D.H2(g)+1/2O2(g)= H2O(g) △H=-285.3kJ·mol-1
难度: 简单查看答案及解析
-
在298K、100kPa时,已知:
H2(g)+Cl2(g)=2HCl(g) △H1
2H2O(g)=2H2(g)+O2(g) △H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3
则△H3与△H1和△H2间的关系正确的是( )
A.△H3=△H1+2△H2 B.△H3=2△H1+△H2
C.△H3=△H1-2△H2 D.△H3=△H1-△H2
难度: 简单查看答案及解析
-
已知:4NH3(g)+5O2(g)
4NO(g)+6H2O(g),若反应速率分别用v (NH3)、v (O2)、v (NO)、v (H2O) [mol•L-1•min-1]表示,则关系正确的是( )
A.4 v (NH3)=5 v (O2) B.5 v (O2)=6 v (H2O)
C.3 v (NH3)=2v (H2O) D.5 v (O2)=4 v (NO)
难度: 中等查看答案及解析
-
可逆反应 A(g)+3B(g)
2C(g)+2D(g),在不同情况下,测得有下列四个反应速率,其反应速率最慢的是( )
A.v(A)=0.15mol•L﹣1•s﹣1 B.v(B)=0.6mol•L﹣1•s﹣1
C.v(C)=0.5mol•L﹣1•s﹣1 D.v(D)=0.4mol•L﹣1•s﹣1
难度: 中等查看答案及解析
-
在一密闭容器中,发生下列可逆反应2X(g)+Y(g)
2Z(g),当减小压强时,化学反应的速率以及平衡移动的方向分别为( )
A.逆反应速率增大,正反应速率减小,平衡向正反应方向移动
B.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向进行
D.正、逆反应速率都增大,平衡向逆反应方向进行
难度: 简单查看答案及解析
-
可逆反应a A(s)+b B(g)
c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图,下列叙述正确的是( )
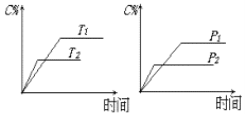
A.达平衡后,若降温,平衡右移
B.达平衡后,加入催化剂则C%增大
C.化学方程式中b >c +d
D.达平衡后,增加A的量有利于平衡向右移动
难度: 简单查看答案及解析
-
对四支分别盛有无色溶液的试管,进行如下操作,结论正确的是
操作
现象
结论
A
滴加氯水和CCl4,振荡、静置
下层溶液显紫红色
原溶液中有I-
B
滴加BaCl2溶液
生成白色沉淀
原溶液中一定有SO42-
C
向10mL 0.2mol/LNaOH溶液中先滴入2滴0.1mol/LMgCl2溶液,再滴加2滴0.1mol/LFeCl3溶液
先有白色沉淀生成,加入FeCl3溶液后,又有红褐色沉淀生成
在相同的温度下的Ksp: Mg(OH)2>Fe(OH)3
D
滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口
试纸不变蓝
原溶液中一定无NH4+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
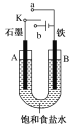
电解稀H2SO4、CuCl2的混合液,最初一段时间阴极和阳极上分别析出的物质分别是
A.H2和Cl2 B.Cu和Cl2 C.H2和O2 D.Cu和O2
难度: 简单查看答案及解析
-
在一固定体积的密闭容器中加入2 mol A和1 mol B发生反应2A(g)+B(g)
3C(g)+D(g),达到平衡时C的浓度为w mol·L-1,若维持容器的体积和温度不变,按下列四种配比方案作为反应物,达平衡后,使C的浓度仍为w mol·L-1的配比是( )
A.4 mol A+2 mol B B.3 mol C+1 mol D+2mol A+1 mol B
C.3mol C+1 mol D+1 mol B D.3 mol C+1 mol D
难度: 中等查看答案及解析
-
室温下,将碳酸钠溶液加热至70℃,其结果是( )
A.溶液中c(CO32-)增大 B.水的电离程度增大
C.溶液的pH将变小 D.溶液的碱性不变
难度: 中等查看答案及解析
-
100℃时将pH=2的强酸与pH=10的强碱溶液混合,所得溶液pH=3,则强酸与强碱的体积比是( )
A.1︰9 B.9︰1 C.11︰90 D.11︰9
难度: 中等查看答案及解析
-
下列各组离子因发生双水解而不能大量共存的是( )
A.Ba2+、Cl-、Na+、SO42- B.Al3+、K+、AlO2-、Cl-
C.H+、Fe2+、NO3-、SO42- D.Fe2+、Na+、Cl-、SO42-
难度: 中等查看答案及解析
-
一定温度下,Mg(OH)2固体在水中达到沉淀溶解平衡:Mg(OH)2 (s)
Mg2+(aq)+2OH–(aq)。要使Mg(OH)2固体质量减少而c(Mg2+)不变,采取的措施可能是( )
A. 加适量水 B. 通HCl气体 C. 加NaOH固体 D. 加MgSO4 固体
难度: 困难查看答案及解析
-
用铂电极电解CuSO4溶液,当c(Cu2+)降至原来的一半时停止通电,则加入下列物质能使溶液恢复成原来浓度的是( )
A.无水CuSO4 B.CuCO3 C.Cu(OH)2 D.CuSO4·5H2O
难度: 中等查看答案及解析
-
常温下,下列各溶液中微粒的物质的量浓度关系正确的是( )
A.浓度分别为0.1 mol·L-1的Na2CO3、NaHCO3溶液:c(CO32-)>c(HCO3-)
B.将pH=6的H2SO4稀释1 000倍后,c(H+)=2c(SO42-)
C.浓度分别为0.1 mol·L-1和0.01 mol·L-1的CH3COOH溶液中:c(CH3COO-)前者是后者的10倍
D.NaA溶液的pH=8,c(Na+)-c(A-)=9.9×10-7mol·L-1
难度: 中等查看答案及解析
-
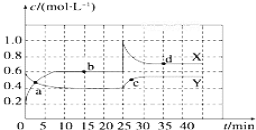
常温下,H2C2O4的电离常数:Ka1=5.4×10-2,Ka2=5.0×10-5。在V1mL0.1mol•L-1H2C2O4溶液中滴加0.1mol•L-1KOH溶液,混合溶液中水电离的c水(H+)与KOH溶液体积V的关系如图所示。下列说法正确的是( )
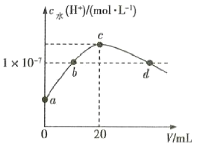
A.V1=20mL
B.b点和d点对应的溶液中都存在:c(K+)=c(HC2O4-)+2c(C2O42-)
C.常温下,加水稀释b点对应的溶液,稀释后溶液pH减小
D.常温下,KHC2O4的Kh1=2×10-10
难度: 中等查看答案及解析