-
“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e- === X + 2H+。下列说法中正确的是
A. 电池内部H+由正极向负极移动
B. 另一极的电极反应式为:O2 + 4e- + 2H2O === 4OH-
C. 乙醇在正极发生反应,电子经过外电路流向负极
D. 电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O
难度: 困难查看答案及解析
-
常温常压下将氢气和氧气混合在一起,即使过上几年,它们也不会发生化合反应生成水。然而只要给一个电火花,氢气就迅速与氧气反应生成水。反应过程中的能量变化如下图A所示。对比下图B中的情景,漫画中的羊供给石头的“能量”相当于图A中的( )
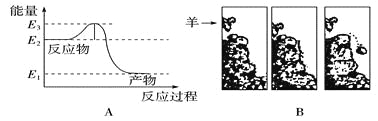
A.E2 B.E2-E1 C.E3-E2 D.E3
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.已知:H+(aq)+OH-(aq)= H2O(l) ΔH=-57.3 kJ·mol-1,则H2SO3(aq)+2NaOH(aq)= Na2SO3(aq)+2H2O(l) ΔH>-114.6 kJ/mol
B.石油、煤、天然气、可燃冰、植物油都属于化石燃料
C.NaCl、SO3、蔗糖分别属于强电解质、弱电解质、非电解质
D.由石墨比金刚石稳定可推知: C(石墨)==C(金刚石) ΔH<0
难度: 简单查看答案及解析
-
在密闭容器中的一定量混合气体发生反应:xA(g) +yB(g)
z C(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍。再达平衡时,测得A的浓度为0.30 mol/L。下列有关判断正确的是( )
A.x+y < z B.平衡向正反应方向移动
C.C的体积分数下降 D.B的转化率升高
难度: 中等查看答案及解析
-
在一定温度下,向一个容积可变的容器中,通入3 mol SO2和2 mol O2及固体催化剂,使之发生反应:2SO2(g)+O2(g)
2SO3(g) ΔH=—196.6 kJ·mol-1,一段时间后达到平衡,平衡时容器内气体总的物质的量为起始时的90%.下列说法正确的是 ( )
A.达到平衡时SO2的转化率约为33.3%
B.达到平衡时反应放出的热量为294.9 kJ
C.平衡时SO3的物质的量为2mol
D.达平衡时用O2表示的反应速率为0.25 mol·L-1·min-1
难度: 中等查看答案及解析
-
在恒温、恒容密闭容器中发生反应: A(s) +2B(g)
C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是
①混合气体的压强 ②混合气体的密度 ③各气态物质的物质的量浓度
④气体的总物质的量 ⑤混合气体的平均相对分子质量
A.②③⑤ B.①②③ C.②③④⑤ D.①③④⑤
难度: 中等查看答案及解析
-
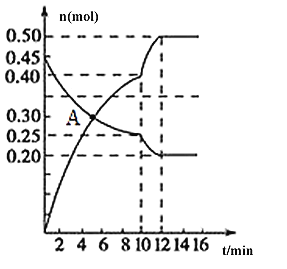
已知反应X(g)+Y(g)
nZ(g) ΔH >0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( )
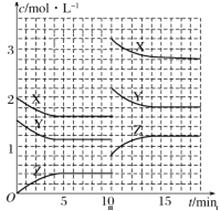
A.反应方程式中n=1
B.10min时,曲线发生变化的原因是升高温度
C.10min时,曲线发生变化的原因是增大压强
D.前5min后,用X表示的反应速率为v(X)=0.08mol·L-1·min-1
难度: 中等查看答案及解析
-
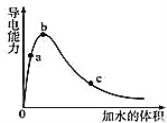
根据下列图示所得出的结论一定错误的是
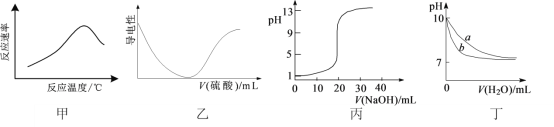
A.图甲表示酶催化反应的反应速率随反应温度的变化
B.图乙表示向BaCl2溶液中滴加稀硫酸至过量的过程中溶液导电性的变化
C.图丙表示用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1醋酸的滴定曲线
D.图丁表示相同温度下,向等体积pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.室温下,稀释0.1mol·L-1CH3COOH溶液,溶液的导电能力增强
B.0.1mol·L-1Na2CO3溶液加热后,溶液的pH减小
C.1 mol/ L和0.01 mol/ L的两瓶氨水中c(OH-)之比为100:1
D.氢氧燃料电池工作时,H2在负极上失去电子
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.S(g)+O2(g)=SO2 (g)可用该反应的ΔH表示燃烧热
B.通过直接蒸发MgCl2溶液的方法获取无水氯化镁固体
C.除去CuCl2溶液中的Fe3+,选用氢氧化钠溶液作沉淀剂
D.一定温度下,反应 MgCl2(l)=Mg(l)+Cl2(g)的ΔH>0、ΔS>0
难度: 中等查看答案及解析
-
今有室温下四种溶液,下列有关叙述不正确的是( )
序号
pH
溶液
①
11
氨水
②
11
氢氧化钠溶液
③
3
醋酸
④
3
盐酸
A.③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C.V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
D.分别加水稀释10倍,四种溶液的pH:①>②>④>③
难度: 中等查看答案及解析
-
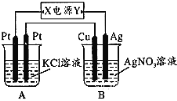
图乙是根据图甲的电解池进行电解时某个量(纵坐标x)随时间变化的函数曲线(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),这个量x是表示( )
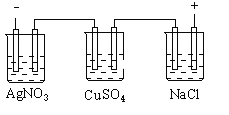
甲 乙
A. 各电池析出气体体积总数的变化 B. 各电解池阳极质量的增加
C. 各电解池阴极质量的增加 D. 各电极上放电的离子总数的变化
难度: 中等查看答案及解析
-
下列有关钢铁腐蚀与防护的说法正确的是

A.钢管与铜管露天堆放在一起,钢管不易被腐蚀
B.在右图所示环境中,铁被腐蚀速率:I>Ⅲ>Ⅱ
C.铁制品保存在温度较高的地方
D.钢铁发生电化学腐蚀时,负极反应是Fe—3eˉ=Fe3+
难度: 中等查看答案及解析
-
关于下列各装置图的叙述不正确的是( )
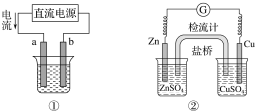
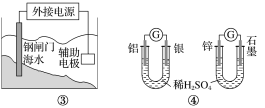
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
难度: 简单查看答案及解析
-
通过加入适量乙酸钠,设计成微生物电池可以将废水中的氯苯转化为苯而除去,其原理如图所示。下列叙述正确的是
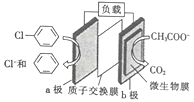
A. b极为正极,发生还原反应
B. 一段时间后b极区电解液的pH减小
C. H+由a极穿过质子交换膜到达b极
D. a极的电极反应式为
-e-=Cl-+
难度: 困难查看答案及解析