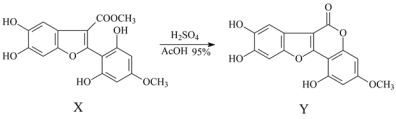
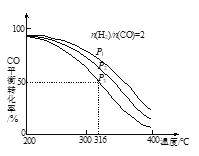
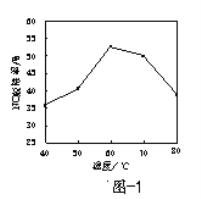
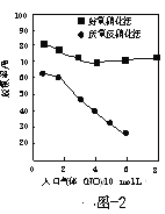
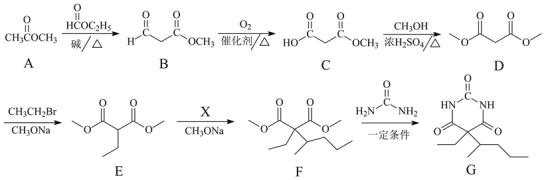
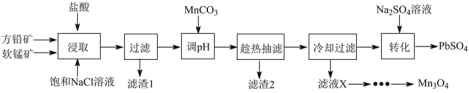
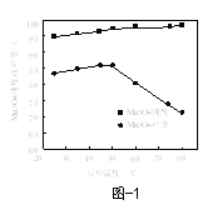
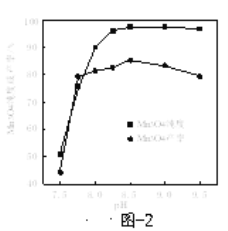
-
2019年11月第四届国际碳材料大会在上海举行,碳材料产品丰富,应用广泛,让人感到“碳为观止”。下列有关说法正确的是
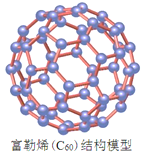
A.金刚石与石墨互为同位素
B.石墨烯是一种有发展前途的导电材料
C.碳纤维、合成纤维、光导纤维都属于高分子材料
D.富勒烯是由60个碳原子都以碳碳单键构成的分子
难度: 中等查看答案及解析
-
用化学用语表示2Na + 2H2O=2NaOH + H2↑中的相关微粒,其中正确的是
A.中子数为10的氧原子:
O B.NaOH的电子式:
C.Na+的结构示意图:
 D.H2O的比例模型:
D.H2O的比例模型:难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A.氨气具有还原性,可用作制冷剂
B.次氯酸具有弱酸性,可用作有色物质的漂白剂
C.浓硫酸具有强氧化性,可用作酯化反应的催化剂
D.碳酸钠溶液显碱性,可用其热溶液除去金属餐具表面油污
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是
A.0.l mol ·L−1的H2SO4溶液:NH4+、Fe2+、Cl−、NO3-
B.0.l mol ·L−1的FeCl3溶液:K+、Al3+、SO42-、NO3-
C.0.l mol ·L−1的Na2SO3溶液:Ba2+、K+、ClO-、MnO4-
D.0.l mol ·L−1的Ba(OH)2溶液:Mg2+、Na+、HCO3-、Cl−
难度: 中等查看答案及解析
-
下列有关实验原理或操作正确的是
A.用图甲所示装置配制银氨溶液
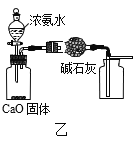
B.用图乙所示装置制取并收集干燥纯净的NH3
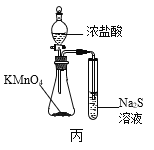
C.用图丙所示装置可以比较KMnO4、Cl2、S的氧化性
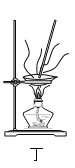
D.用图丁所示装置蒸干CuSO4溶液制备胆矾晶体
难度: 中等查看答案及解析
-
下列有关化学反应的叙述正确的是
A.将Na2O2投入NH4Cl溶液中只可能生成一种气体
B.铁分别与稀盐酸和氯气反应,产物中铁元素的化合价相同
C.SO2通入BaCl2溶液有白色沉淀BaSO3生成
D.向滴有酚酞的Na2CO3溶液中加入足量CaCl2溶液,溶液红色褪去
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B.向KClO3溶液中滴加稀盐酸:ClO3-+Cl-+6H+=Cl2↑+3H2O
C.向Al2(SO4)3溶液中滴加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
难度: 中等查看答案及解析
-
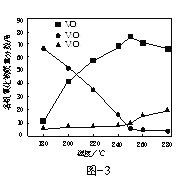
短周期主族元素X、Y、Z、W原子序数依次增大,Y的原子半径是短周期主族元素原子中最大的,X与Z属于同一主族,Z的最外层电子数为最内层电子数的3倍。下列说法正确的是
A.原子半径: r(Y)>r(W)>r(Z)>r(X)
B.由X、Y组成的化合物中均不含共价键
C.W的氧化物对应水化物的酸性比Z的强
D.X的简单气态氢化物的热稳定性比Z的强
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的转化关系均能实现的是
A.HClO
Cl2
SiCl4
B.NH3
NO
HNO3
C.FeS2
SO3
H2SO4
D.MgCl2·6H2O
无水MgCl2
Mg
难度: 中等查看答案及解析
-
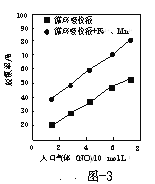
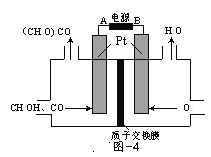
为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D−Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D−Zn—NiOOH二次电池,结构如图所示。电池反应为Zn+2NiOOH+H2O
ZnO+2Ni(OH)2。下列说法错误的是
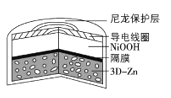
A.放电过程中OH−通过隔膜从负极区移向正极区
B.充电时阳极反应为Ni(OH)2+OH−−e−=NiOOH+H2O
C.放电时负极反应为Zn+2OH−−2e−=ZnO+H2O
D.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
难度: 中等查看答案及解析
-
下列说法正确的是
A.常温下,向稀醋酸溶液中缓慢通入NH3,溶液中
的值增大
B.298K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH<0
C.标准状况下,将22.4 L Cl2通入足量NaOH溶液中,反应转移的电子数为2×6.02×1023
D.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
向KI溶液中滴入少量新制氯水和四氯化碳,振荡、静置,溶液下层呈紫红色
I−的还原性强于Cl−
B
向无水乙醇中加入浓H2SO4,加热,将产生的气体通入酸性KMnO4溶液,紫红色褪去
该气体一定是乙烯
C
测定Na2CO3和Na2SiO3溶液的pH,后者pH比前者的大
C的非金属性比Si强
D
向1-溴丙烷中加入KOH溶液,加热几分钟,冷却后再加入AgNO3溶液,无淡黄色沉淀生成
1-溴丙烷没有水解
A.A B.B C.C D.D
难度: 中等查看答案及解析