-
以下是常温下几种弱酸的电离平衡常数:
CH3COOH
H2S
HClO
K=1.8×10-5
K1=1.3×10-7
K2=7.1×10-15
K=4.69×10-11
下列说法正确的是
A.可发生反应:H2S+ 2ClO-=S2-+ 2HClO
B.CH3COOH溶液与Na2S溶液不能反应生成NaHS
C.同物质的量浓度的Na2S、NaClO、CH3COONa溶液,pH最大的是NaClO溶液
D.同物质的量浓度的H2S、HClO、CH3COOH溶液,酸性最强的是CH3COOH
难度: 中等查看答案及解析
-
常温下0.1mol/L NH4Cl溶液的pH最接近于( )
A.1 B.5 C.7 D.13
难度: 简单查看答案及解析
-
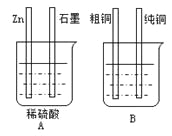
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c上产生大量气泡;b、d相连时b上有大量气泡产生,则四种金属的活动性顺序由强到弱为( )
A.a>c>d>b B.a>b>c>d C.c>a>b>d D.b>d>c>a
难度: 简单查看答案及解析
-
下列说法正确的是
A.强电解质的导电能力一定比弱电解质强
B.CO2的水溶液导电能力很弱,所以CO2是弱电解质
C.在AlCl3溶液中,水的电离程度一定比纯水更大
D.弱电解质在溶液里达到电离平衡时,弱电解质分子的浓度和离子的浓度相等
难度: 中等查看答案及解析
-
为使Na2S溶液中c(Na+)/c(S2-)的值减小,可加入的物质是
①盐酸 ②适量的NaOH溶液 ③适量的KOH溶液 ④适量的K2S固体
A.①② B.②③ C.③④ D.①④
难度: 简单查看答案及解析
-
常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3·H2O溶液。下列说法正确的是
A.同物质的量浓度的三种溶液的pH:a=b>c
B.同pH时,三种溶液稀释相同倍数后,pH:a=b<c
C.同pH、同体积的三种溶液消耗同浓度盐酸的体积:a=b=c
D.同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c
难度: 中等查看答案及解析
-
某化学课外小组的同学通过实验探究温度和浓度对反应速率的影响。实验原理及方案:在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应生成碘,反应原理是:2IO3-+5SO32-+2H+=I2+5SO42-+H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
实验序号
0.01mol·L-1KIO3酸性溶液(含淀粉)的体积/mL
0.01mol·L-1
Na2SO3 溶液的体积/mL
水的体积/mL
实验温度/℃
出现蓝色的时间/s
①
5
5
V1
5
t1
②
5
5
40
25
t2
③
5
V2
35
25
t3
下列判断不正确的是
A.最先出现蓝色的一组实验是③
B.实验①③中V1=40,V2=10
C.探究温度对化学反应速率的影响应该选择实验①②
D.出现蓝色的时间t3>t2>t1
难度: 简单查看答案及解析
-
在生产、生活中为增大反应速率而采取的措施合理的是
A. 食物放在冰箱中
B. 在食品中添加适量防腐剂
C. 在糕点包装内放置小包除氧剂
D. 工业上燃烧硫铁矿制取SO2时,先将矿石粉碎
难度: 中等查看答案及解析
-
常温时,将CH3COOH溶液和NaOH溶液等体积混合后,溶液呈中性。则下列各项正确的是 ( )。
A.混合前:pH(CH3COOH)+pH(NaOH)=14
B.混合后:c(Na+)=c(CH3COO-)+c(OH-)
C.混合前:c(CH3COOH)>c(NaOH)
D.混合后:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
下列过程一定不能自发进行的是( )
A.2N2O5(g)=4NO2(g)+O2(g) ΔH>0
B.2H2(g)+O2(g)=2H2O(l) ΔH<0
C.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ΔH>0
D.2CO(g)=2C(s)+O2(g) ΔH>0
难度: 简单查看答案及解析
-
下列金属防腐的措施中,属于牺牲阳极的阴极保护法的是( )
A.地下钢管连接锌板 B.水中的钢闸门连接电源的负极
C.铁件镀铜 D.金属护拦表面涂漆
难度: 简单查看答案及解析
-
下列能量的转化过程中,由化学能转化为电能的是
A
B
C
D




铅蓄电池放电
风力发电
水力发电
太阳能发电
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
已知:CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH = -Q1
2H2(g) + O2(g) = 2H2O(g) ΔH = -Q2; 2H2(g) + O2(g) = 2H2O(l) ΔH = -Q3
常温下,取甲烷和氢气体积比为4:1的混合气体11.2L(已折合成标准状况),完全燃烧后恢复至室温,则放出的热量为( )
A.0.4Q1 + 0.05Q2 B.0.4Q1 + 0.05Q3 C.0.4Q1 + 0.1Q2 D.0.4Q1 + 0.1Q3
难度: 中等查看答案及解析
-
50mL0.50mol·L-1盐酸与50mL0.55 mol·L -1NaOH 溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是
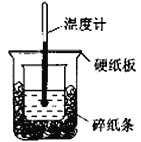
A.在测定中和热的实验中,至少需要测定并记录的温度是3次
B.大烧杯上如不盖硬纸板,测得的中和热数值会偏小
C.用相同浓度和体积的氨水代替NaOH 溶液进行上述实验,测得中和热的数值会偏大
D.从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题
难度: 简单查看答案及解析
-
下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是
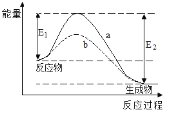
A.该反应为吸热反应
B.a与b相比,a的反应速率更快
C.a与b相比,反应的平衡常数一定不同
D.E2大于E1,说明总能量生成物比反应物低
难度: 简单查看答案及解析
-
下列实验事实不能用平衡移动原理解释的是
A.pH=11的氨水稀释10倍后溶液pH>10
B.将氯化铝溶液加热蒸干并灼烧,最终得氧化铝固体
C.对2HI(g)
H2(g)+I2(g),减小容器体积,气体颜色变深
D.水垢中含有CaSO4,可先用Na2CO3溶液浸泡处理,而后用盐酸去除
难度: 中等查看答案及解析
-
已知某反应aA(g)+bB(g)
cC(g)的各物质浓度数据如下:
A
B
C
起始浓度(mol·L−1)
3.0
1.0
0
2 s末浓度(mol·L−1)
1.8
0.6
0.8
据此可推算出a∶b∶c是( )
A.9∶3∶4 B.3∶1∶2 C.2∶1∶3 D.3∶2∶1
难度: 简单查看答案及解析
-
在不同情况下测得
的下列反应速率,其中反应速率最大的是( )
A.v (D)=0.8 mol/(L·s) B.v (C)=0.5 mol/(L·s) C.v (B)=0.6 mol/(L·s) D.v (A)= 0.2 mol/(L·s)
难度: 简单查看答案及解析
-
在容积相同的两个密闭容器M和N中,保持温度为150 ℃,向M容器中加入amol HI,同时向N容器中加入bmol HI (a>b)。当反应2HI(g)
H2(g) + I2(g) 达到平衡后,下列说法正确的是
A.从反应开始到达到平衡,所需时间tM >tN
B.平衡时cM(I2) =cN(I2)
C.平衡时I2蒸气在混合气体中的体积分数:M > N
D.HI的平衡分解率αM =αN
难度: 中等查看答案及解析
-
某化学研究小组探究外界条件对化学反应mA(g)+nB(g)⇌ pC(g)的速率和平衡的影响图象如下,下列判断正确的是
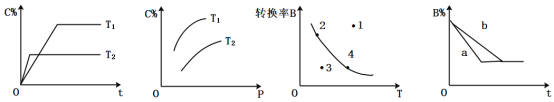
A.由图1可知,
,该反应正反应为吸热反应
B.由图2可知,该反应
C.图3中,点3的反应速率:v正>v逆
D.图4中,若
,则a曲线一定使用了催化剂
难度: 简单查看答案及解析
-
下列表示化学过程的化学用语书写正确的是
A.用中和热表示氢氧化钠和醋酸的稀溶液反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l) △H=57.3kJ·mol-1
B.AlCl3溶液与NaAlO2溶液混合:A13++A1O2-+3H2O
2Al(OH)3↓
C.HCO3-的电离:HCO3-+H2O
CO32-+H3O+
D.Na2SO3的水解:SO32-+2H2O
H2SO3+2OH-
难度: 中等查看答案及解析
-
对于下列化学平衡在一定条件下发生移动的描述,不正确的是
A. Cl2+H2O
HCl+HClO,氯水中加入碳酸钙,漂白性增强
B. ZnS + Cu2+
CuS + Zn2+,闪锌矿(ZnS)遇CuSO4溶液转化为铜蓝(CuS)
C. 2NO2
N2O4 ΔH<0,将装有NO2的玻璃球浸入热水中,红棕色变浅
D. Cr2O72-(橙色)+H2O
2CrO42-(黄色) +2H+,K2Cr2O7溶液中滴加几滴浓硫酸,橙色加深
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,该电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是( )
A.放电时正极附近溶液的碱性减弱
B.充电时阳极反应为:Fe(OH)3-3eˉ+5OHˉ=FeO42ˉ+4H2O
C.放电时每转移 3 mol 电子,正极有 1 mol K2FeO4 被还原
D.放电时负极反应为:Zn-2eˉ+2OHˉ=Zn(OH)2
难度: 中等查看答案及解析
-
化学与生活、社会发展息息相关。下列说法错误的是
A.燃料电池的能量转化率可达100%
B.用可溶性的铝盐或铁盐处理水中的悬浮物
C.体积分数75%的乙醇溶液可用于医疗消毒
D.食品中用木糖醇作甜味剂,可降低糖尿病的发病率
难度: 简单查看答案及解析
-
下列选项中,微粒的物质的量浓度关系正确的是
A.0.1 mol/L K2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B.0.1 mol/L NaHCO3溶液中离子浓度关系:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3)
C.等物质的量的一元弱酸HX与其钾盐KX的混合溶液中:2c(K+)= c(HX)+c(X-)
D.浓度均为0.1 mol/L的NaHCO3溶液和NaOH溶液等体积混合:c(Na+)+ c(H+)=c(CO32-)+c(OH-)+c(HCO3-)
难度: 中等查看答案及解析