-
有机物与生活、生产密切相关,下列说法不正确的是( )
A.天然气的主要成分是CH4 B.乙烯对某些植物具有催熟的作用
C.苯及其部分同系物主要通过石油的分馏获取 D.氟氯代烃可对臭氧层产生破坏作用
难度: 中等查看答案及解析
-
下列有机物的命名,正确的( )
A.
2-甲基丁烷
B.CH2=CH-CH=CH2 1,3-二丁烯
C.
1,3,4-三甲基苯
D.CH2Cl-CH2Cl 二氯乙烷
难度: 简单查看答案及解析
-
下列各组反应,属于同一反应类型的是( )
A.由溴乙烷制乙醇;由乙烯制乙醇
B.由甲苯制三氯甲苯;由甲苯制苯甲酸
C.由氯代环己烷制环己烯;由丙烯制1,2-二溴丙烷
D.由甲烷制四氯化碳;由苯制溴苯
难度: 简单查看答案及解析
-
分子式为C4H7Cl的链状有机物共有(不考虑立体异构)( )
A.6种 B.7种 C.8种 D.9种
难度: 中等查看答案及解析
-
关于有机物X(
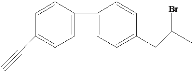 )下列说法不正确的是( )
)下列说法不正确的是( )A.X中不可能所有原子共平面 B.X中最多4个碳原子共线
C.1molX被加成时最多消耗8molH2 D.X可发生消去反应,且能得到两种有机产物
难度: 中等查看答案及解析
-
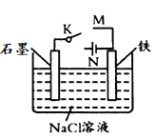
下列实验方案可行的是( )
A.将饱和食盐水与电石反应产生的气体直接通入酸性KMnO4溶液中,检验乙炔
B.苯的硝化实验后,向反应液中加水,验证硝基苯的密度比水大
C.CH3CH2Br的水解实验中,通过分层现象是否完全消失,判断其水解是否完全
D.CH3CH2I水解实验后,取水解液,加入AgNO3溶液,检验卤素离子
难度: 中等查看答案及解析
-
为提纯下列物质(括号内为杂质,不考虑引入的水蒸气),有关除杂试剂和分离方法的选择不正确的是( )
选项
被提纯的物质
除杂试剂
分离方法
A
CH3CH3(CH2=CH2)
溴水
洗气
B
CH3CH2Br(Br2)
NaOH溶液
分液
C
溴苯(苯)
蒸馏
D
乙烯(乙醇蒸气)
水
洗气
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列物质与Br2在一定条件下反应,可能生成的溴代烃数目最多的是( )(不考虑立体异构)
A
B
C
D
反应物
CH3CH3
反应条件
光照
常温,无光
FeBr3,无光
常温,无光
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.天然弱碱性水呈碱性的原因是其中含有较多的Ca2+、Mg2+等离子
B.纯碱可去油污与盐类水解无关
C.100mL0.1mol/L Na2CO3溶液中含有的阴离子数目大于0.01NA
D.蒸干FeCl3溶液可得到FeCl3固体
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能够大量共存的是( )
A.使甲基橙变黄色的溶液:Fe2+、K+、NO3-、Cl-
B.能与Al反应放出H2的溶液:K+、Mg2+、SO42-、AlO2-
C.
=10-3的溶液中:Cl-、NO3-、NH4+、Ba2+
D.由水电离出的c(H+)=1×10-12mol·L-1的溶液中:Na+、K+、CrO42-、ClO-
难度: 中等查看答案及解析
-
已知25℃时FeS、CuS的Ksp分别为6.3×10-18、1.3×10-36,H2S的电离平衡常数Ka1=9.1×10-8、Ka2=1.1×10-12,下列有关说法正确的是( )
A.除去工业废水中的Cu2+可以选用FeS作沉淀剂
B.将足量CuSO4固体溶解在0.1mol/L H2S溶液中,Cu2+的最大浓度为1.3×10-35mol/L
C.因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+ H2SO4不能发生
D.向H2S的饱和溶液中通入少量SO2气体,溶液的酸性增强
难度: 中等查看答案及解析
-
常温下,下列有关叙述中不正确的是( )
A.等体积、等pH的氢氧化钠溶液和氨水,分别与等浓度的硫酸反应,氨水消耗的硫酸多
B.pH=3的稀硫酸跟pH=11的氢氧化钠溶液等体积混合,混合溶液的pH<7
C.通过测定100mL1mol/L的氯化钠溶液和醋酸钠溶液的pH的大小,可达到比较盐酸和醋酸酸性强弱的目的
D.等体积、等浓度的盐酸和醋酸溶液与足量锌反应,整个过程的平均反应速率盐酸快
难度: 中等查看答案及解析
-
常温下,下列有关叙述不正确的是( )
A.若NH4Cl溶液的pH=6,则c(Cl-)—c(NH4+)=9.9×10-7mol/L
B.CH3COONa和CaCl2混合溶液中:c(Na+) + c(Ca2+) =c(CH3COO-) + c(CH3COOH) +2 c(Cl-)
C.已知H2A的Ka1=4.17×10-7,Ka2=4.9×10-11,则NaHA溶液呈碱性
D.常温下pH相同的①NH4Cl②NH4Al(SO4)2③(NH4)2SO4三种溶液中c(NH4+):①=③>②
难度: 困难查看答案及解析
-
常温下,向20mL0.1mol/L氨水溶液中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是( )
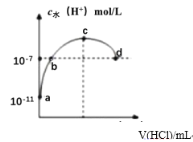
A.常温下,NH3·H2O的电离常数约为1×10-5
B.a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.c点溶液中:c(NH4+)= c(Cl-)
D.d点代表两溶液恰好完全反应
难度: 中等查看答案及解析
-
我国科学家成功研制出新型铝-石墨烯(Cn)可充电电池,电解质为阳离子(EMIM+)与阴离子(AlCl4-)组成的离子液体,该电池放电过程如图。下列说法错误的是( )
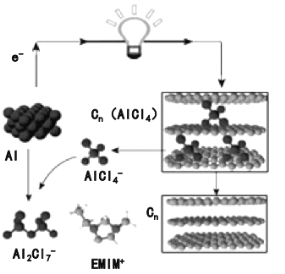
A.放电时电路中每转移1mol电子,有1molCn(AlCl4)被还原
B.放电时正极的反应为:Cn+AlCl4--e-=Cn(AlCl4)
C.充电时石墨烯与电源的正极相连
D.充电时的总反应为:3Cn+4Al2Cl7-
Al+4AlCl4-+3Cn(AlCl4)
难度: 中等查看答案及解析
-
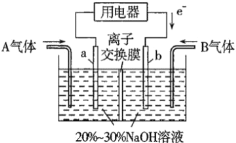
以K2CrO4为原料,电化学法制备K2Cr2O7的实验装置示意图如图,下列说法正确的是( )

A.在阴极室,发生的电极反应为2H2O-2e-=2OH-+H2↑
B.在阳极室,通电后溶液逐渐由橙色(Cr2O72-)变为黄色(CrO42-)
C.该制备过程中,阴极室中的K+透过阳离子交换膜向阳极室移动
D.测定阳极液中K和Cr的含量,若某时刻K与Cr的物质的量之比(nK/nCr)为x,则此时K2CrO4的转化率为2-x
难度: 中等查看答案及解析
 )一种可用于治疗肿瘤的药物。实验室由烃A和烃D制备J的合成路线如图:
)一种可用于治疗肿瘤的药物。实验室由烃A和烃D制备J的合成路线如图:
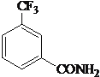 结构,则符合条件的M共有___种。
结构,则符合条件的M共有___种。