-
某化妆品因在CCTV8一段仅15秒的广告被舆论讨伐。这段广告中某著名歌手连喊三次:“我们恨化学”这句话,甚至直接用这五个大字占满屏幕,其目的是宣传产品的“纯天然”性。下列有关说法不正确的是( )
A.绿色化学的核心是应用化学原理治理环境污染
B.可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素
C.化妆品中的“天然植物精华”在提取过程中可能用到化学中的萃取、蒸馏技术
D.苯是重要化工原料 ,以煤和石油为原料通过化学变化均可得到苯
难度: 简单查看答案及解析
-
某饱和一元酯C5H10O2,在酸性条件下水解生成甲和乙两种有机物,乙在铜的催化作用下能氧化成醛,满足以上条件的酯有( )
A.6种 B.7种 C.8种 D.9种
难度: 中等查看答案及解析
-
根据下列实验和现象,所得实验结论正确的是( )
实验
现象
实验结论
A
向某溶液中先滴加适量硝酸,再滴加少量BaCl2溶液
出现白色沉淀
原溶液中含有SO42-,SO32-,HSO3-中的一种或几种
B
将纯碱和盐酸反应生成的气体,通入一定浓度Na2SiO3溶液中
出现白色胶状沉淀
酸性:HCl>H2CO3>H2SiO3
C
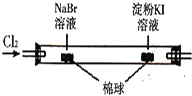
左边棉球变为橙色,右边棉球变为蓝色
氧化性:Cl2>Br2>I2
D
葡萄糖溶液与新制Cu(OH)2悬浊液混合加热
生成砖红色沉淀
葡萄糖分子中含有醛基
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是()
A.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA
B.14g分子式为CnH2n的链烃中含有的C—H键的数目为2NA
C.室温时,1.0LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
D.Fe与水蒸汽反应生成22.4L氢气,转移电子数为2NA
难度: 中等查看答案及解析
-
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是
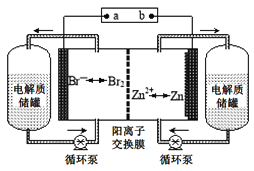
A.阳离子交换膜可阻止Br2与Zn直接发生反应
B.放电时正极的电极反应式为Br2+2e-=2Br-
C.充电时电极b连接电源的正极
D.放电时左侧电解质储罐中的离子总浓度增大
难度: 中等查看答案及解析
-
下表是25 ℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
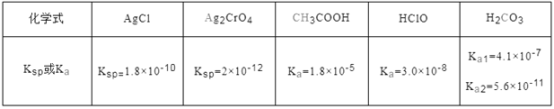
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 碳酸钠溶液中滴加少量氯水的离子方程式H2O+2CO32-+Cl2===2HCO3-+Cl-+ClO-
C. 向0.1 mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=9:5,此时溶液pH=5
D. 向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol· L-1的AgNO3溶液,CrO42-先形成沉淀
难度: 中等查看答案及解析
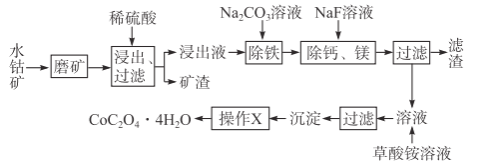
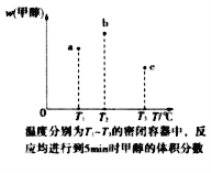
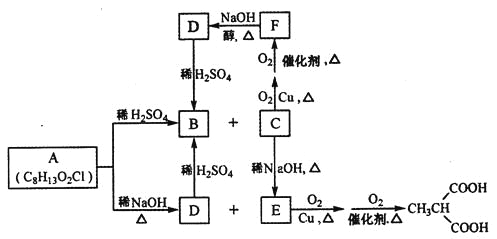
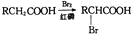 ,请以2一甲基丙醇和甲醇为原料,设计制备有机玻璃(聚甲基丙烯酸甲酯)的合成路线.合成路线流程图示例如下:___________________
,请以2一甲基丙醇和甲醇为原料,设计制备有机玻璃(聚甲基丙烯酸甲酯)的合成路线.合成路线流程图示例如下:___________________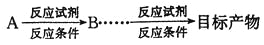 。
。