-
下列诗句、谚语或与化学现象有关,说法不正确的是
A. “水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化
B. “落汤螃蟹着红袍”肯定发生了化学变化
C. “滴水石穿、绳锯木断”不包含化学变化
D. “看似风平浪静,实则暗流涌动”形象地描述了溶解平衡的状态
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,11.2LSO3中含有原子数为2NA
B.用浓盐酸分别与MnO2、KClO3反应制备1molCl2,均转移电子2NA
C.将0.1molNH4NO3溶于适量的稀氨水,溶液恰好呈中性,溶液中NH4+数目小于0.1NA
D.2molNO和1molO2充分反应后,所得混合气体的分子数小于2NA
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.淀粉、纤维素、油脂都是高分子化合物
B.石油分馏和煤的干馏过程,都属于物理变化
C.甲烷、汽油、柴油、酒精都是碳氢化合物,都可作燃料
D.聚乙烯是无毒高分子材料,可用于制作食品包装袋
难度: 中等查看答案及解析
-
为制取含HClO浓度较高的溶液,下列图示装置和原理均正确,且能达到实验目的的是
A.
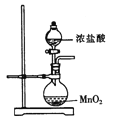 制取氯气 B.
制取氯气 B.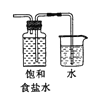 制取氯水
制取氯水C.
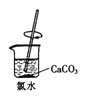 提高HClO浓度 D.
提高HClO浓度 D.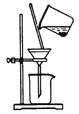 过滤
过滤难度: 中等查看答案及解析
-
依据Cd(Hg)+Hg2SO4=3Hg+Cd2++SO42-反应原理,设计出韦斯顿标准电池,其简易装置如图。下列有关该电池的说法正确的是( )

A.电池工作时Cd2+向电极B移动
B.电极A上发生反应Hg2SO4+2e-=2Hg+SO42-
C.电极B上发生反应Cd(Hg)-4e-=Hg2++Cd2+
D.反应中每生成a mol Hg转移3a mol电子
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是( )
A.乙硫醇(C2H5SH)的沸点比乙醇的高
B.除去乙酸乙酯中的少量乙醇可加入适量乙酸并充分加热
C.等质量的苯和苯乙烯(
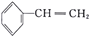 )完全燃烧,消耗氧气的体积相同
)完全燃烧,消耗氧气的体积相同D.分子式为C4H8Cl2且含有两个甲基的有机物有4种
难度: 中等查看答案及解析
-
M是一种化工原料,可以制备一系列物质(见下图)。
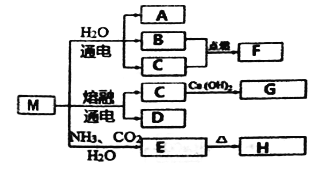
下列说法正确的是
A. 元素C、D形成的简单离子半径,前者大于后者
B. F的热稳定性比H2S弱
C. 化合物A、F中化学键的类型相同
D. 元素C、D的最高价氧化物的水化物均可以和H发生反应
难度: 中等查看答案及解析
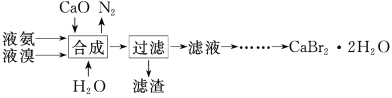
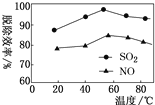

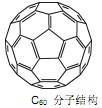
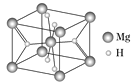



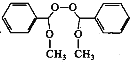 的合成路线_________。
的合成路线_________。