-
向四支试管中分别加入少量不同的无色溶液并进行如下操作,其中结论正确的是
选项
操作
现象
结论
A
滴加BaCl2溶液
生成白色沉淀
原溶液中有SO42—
B
滴加氯水和CCl4,振荡、静置
下层溶液显紫红色
原溶液中有I-
C
用洁净的铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有Na+、无K+
D
滴加几滴稀NaOH溶液,将湿润的红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无NH4+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可判断丙物质是( )
A.Al2(SO4)3 B.NaOH C.BaCl2 D.FeSO4
难度: 中等查看答案及解析
-
用NA代表阿伏加德罗常数的值,下列叙述正确的是 ( )
A.78g过氧化钠晶体中,含2NA个阴离子
B.常温常压下,22.4L氦气含有NA个氦原子
C.在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA
D.常温下16g O2与O3的混合气体中含氧原子数为NA
难度: 简单查看答案及解析
-
下列关于胶体的叙述正确的是
A.胶体粒子不能透过滤纸
B.胶体和溶液的本质区别是胶体能发生丁达尔现象
C.胶体带电,故在电场作用下会产生电泳现象
D.用渗析的方法净化胶体时,使用半透膜只能让小分子和离子通过
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中: Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的溶液中: NH4+、Al3+、NO3-、Cl-
D.加入苯酚显紫色的溶液: K+、ClO-、SO42-、SCN-
难度: 中等查看答案及解析
-
分类是化学学习与研究的常用方法,下列分类正确的是
A.Na2O、MgO、Al2O3均属于碱性氧化物
B.石灰石、生石灰、熟石灰均属于碱
C.酸、碱、盐之间发生的反应均属于复分解反应
D.混合物、分散系、胶体从属关系如右图所示

难度: 简单查看答案及解析
-
2011年9 月29日,“长征-2F”运载火箭成功将“天宫一号”目标飞行器送上太空,火箭中使用的燃料是偏二甲肼(CH3-NH-NH-CH3)和四氧化二氮(N2O4)。在火箭升空过程中,燃料发生反应:CH3-NH-NH-CH3+2N2O4→2CO2+3N2+4H2O提供能量。下列叙述正确的是
A.该燃料绿色环保,在燃烧过程中不会造成任何环境污染
B.该反应中N2O4是氧化剂,偏二甲肼是还原剂
C.CO2是氧化产物,N2是还原产物
D.每有0.6 mol N2生成,转移电子数目为2.4NA
难度: 中等查看答案及解析
-
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
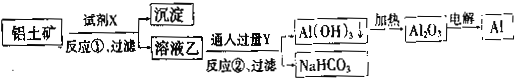
下列叙述正确的是( )
A.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
B.反应①、过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.试剂X可以是氢氧化钠溶液,也可以是盐酸
难度: 简单查看答案及解析
-
下列说法中正确的是 ( )
A.1 L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1 mol/L
B.从1L2mol/L的H2SO4溶液中取出0.5L,该溶液的浓度为1mol/L
C.配制500mL0.1 mol·L-1的CuSO4溶液,需8.0g 无水CuSO4
D.中和100mL1mol/L的H2SO4溶液,需NaOH为4.0 g
难度: 中等查看答案及解析
-
0.6mol·L-1Fe2(SO4)3和1.2mol·L-1CuSO4的混合溶液200mL,加入一定量铁粉充分反应后,测得溶液中Fe2+与Cu2+物质的量之比为2:1,则加入铁粉的物质的量为( )
A.0.30mol B.0.22mol C.0.16mol D.0.48mol
难度: 中等查看答案及解析
-
对
的表述不正确的是
A.该物质能发生缩聚反应
B.该物质的核磁共振氢谱上共有7个峰
C.该物质遇FeCl3溶液显色,1mol该物质最多能与含1mol Br2的溴水发生取代反应
D.1 mol该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为2:2:1
难度: 中等查看答案及解析
-
有一真空储气瓶,净重500g。在相同条件下,装满氧气后重508g,装满另一种气体X 时重511g,则X的相对分子质量为( )
A.44 B.48 C.64 D.71
难度: 简单查看答案及解析
-
甲酸甲酯、乙酸丁酯、丙酸甲酯组成的混合酯中,若氧元素的质量分数为30%,那么氢元素的质量分数为
A.10% B.15% C.20% D.无法确定
难度: 中等查看答案及解析
-
由两分子乙炔聚合得到CH2=CH—C≡CH ,继续和氯化氢发生加成反应得到CH2=CH—CCl=CH2,所得产物加成聚合后得到354g
CH2CH=CClCH2
,则所需乙炔的质量为( )
A.624g B.416g C.312g D.208g
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是( )
A.醋酸钠的水解反应
+H3O+=CH3COOH+ H2O
B.碳酸氢钙与过量的NaOH溶液反应Ca2++2
+2
=CaCO3↓+ 2H2O+
C.苯酚钠溶液与二氧化碳反应 C6H5O—+ CO2+ H2O=C6H5OH+
D.稀硝酸与过量的铁屑反应 3Fe+8H++2
=3Fe3++2NO↑+4 H2O
难度: 简单查看答案及解析
-
下列有关NaHCO3和Na2CO3性质的比较中,正确的是 ( )
A. 热稳定性:Na2CO3<NaHCO3
B. 常温时在水中的溶解度:Na2CO3<NaHCO3
C. 等物质的量的NaHCO3和Na2CO3与足量稀盐酸反应,NaHCO3放出的CO2多
D. 等质量的NaHCO3和Na2CO3与足量稀盐酸反应产生CO2的量:Na2CO3<NaHCO3
难度: 中等查看答案及解析
-
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。反应中镁和铝的
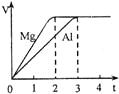
A.物质的量之比为3︰2 B.质量之比为3︰2
C.摩尔质量之比为2︰3 D.反应速率之比为2︰3
难度: 中等查看答案及解析
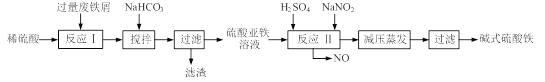 已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表: