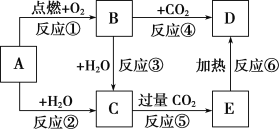
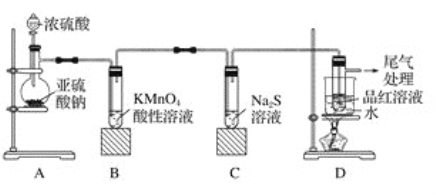
-
我国已跨入“互联网+”时代,而“互联网+”的建设离不开无机非金属材料硅。 下列物品中用到硅单质的是( )
A. 陶瓷餐具 B. 石英钟表 C. 计算机芯片 D. 光导纤维
难度: 简单查看答案及解析
-
《环境空气质量标准》将PM2.5纳入强制监测指标,迄今为止,中国空气污染物监测指标应包括:①二氧化硫、②一氧化碳、③二氧化氮、④可吸入颗粒物(PM10)、⑤PM2.5。上述5种检测物中,能形成酸雨的是
A. ④⑤ B. ①②③ C. ①③ D. ①②④⑤
难度: 中等查看答案及解析
-
已知三个氧化还原反应:①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,③2KMnO4+16HCl(浓)= 2KCl+2MnCl2+8H2O+5Cl2↑。若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而不氧化Fe2+和Cl-,则可加入的试剂是( )
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
难度: 中等查看答案及解析
-
化学与生活、社会发展息息相关,下列说法不正确的是( )
A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B.《本草纲目》中“用浓酒和糟入甑,蒸令气上,用器承滴露”,利用到蒸馏
C.“春蚕到死丝方尽,蜡炬成灰泪始干”诗句中涉及氧化还原反应
D.“青蒿一握,以水二升渍,绞取汁”,体现了屠呦呦对青蒿素的提取属于化学变化
难度: 中等查看答案及解析
-
人体血红蛋白中含有Fe2+,若误食亚硝酸盐,则使血红蛋白中Fe2+转化为Fe3+而丧失其生理功能,临床证明服用维生素C可以解毒,下列叙述错误的是( )
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.56gN2与CO的混合物中原子总数是4NA
B.0.1mol/L的硫酸溶液中含H+的数目为0.2 NA
C.3mol单质Fe完全燃烧转变为Fe3O4,Fe得到8NA个电子
D.标准状况下,22.4L SO3所含的氧原子数目为3NA
难度: 简单查看答案及解析
-
下列实验能达到实验目的且符合操作要求的是
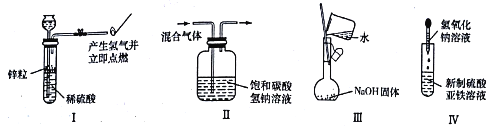
A. I可用于制备并检验氢气的可燃性
B. II可用于除去CO2 中的HCl
C. 用Ⅲ来配制一定物质的量浓度的NaOH 溶液
D. 用IV中操作制备氢氧化亚铁并观察其颜色
难度: 简单查看答案及解析
-
下列有关铁及其化合物的叙述中,不正确的是( )
A.高温下,铁和水蒸气反应可以生成氢气
B.将饱和氯化铁溶液滴入沸水中,煮沸至红褐色,可以制得氢氧化铁胶体
C.用
溶液鉴别
溶液和
溶液
D.
常用作红色油漆和涂料
难度: 简单查看答案及解析
-
下列各组离子在溶液中一定能够大量共存的是
A.在含有大量SO42-的无色溶液中:Mg2+、Na+、Cu2+、Cl-
B.在强酸性溶液中: K+、HCO3-、SO42- 、ClO-
C.在含有大量OH-的溶液中:NO3-、Na+、Cl-、AlO2-
D.在含有大量Fe2+的溶液中:H+、Na+、Cl-、ClO-
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.S在过量的O2中充分燃烧,可得SO3
B.除去在Na2CO3固体中混有的NaHCO3的最好办法是通入过量的CO2
C.鉴别NaHCO3溶液与Na2CO3溶液,可用澄清的石灰水
D.等物质的量Na2CO3和NaHCO3与盐酸反应,消耗HCl的物质的量之比为2:1
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O
B.氯气与水反应:Cl2 + H2O
2H+ + Cl- + ClO-
C.碳酸钙与醋酸溶液反应:CaCO3+2H+=Ca2++CO2↑+H2O
D.向A12(SO4)3溶液中加入过量的氨水:A13++3NH3·H2O=A1(OH)3↓+3NH4+
难度: 简单查看答案及解析
-
如图所示的试管中装有12 mL一氧化氮,然后间歇缓慢地通入8 mL氧气。

有关最终状态的描述:①试管内气体呈红棕色,②试管内气体呈无色,③试管内液面不变,④试管内液面上升,⑤试管内气体是氧气,⑥试管内气体是一氧化氮。其中正确的是( )
A.②④⑥ B.①③ C.②④⑤ D.②③⑤
难度: 中等查看答案及解析
-
有一包白色粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验:①将部分粉末加入水中,振荡,有白色沉淀生成。②向①的悬浊液中加入过量稀盐酸,白色沉淀消失,并有气泡产生;③取少量②的溶液滴入AgNO3溶液,有白色沉淀生成。下列关于白色粉末组成的判断正确的是 ( )
A.肯定含有CaCl2、K2CO3,可能含有Ba(NO3)2
B.肯定含有Ba(NO3)2、K2CO3,可能含有CaCl2
C.肯定含有K2CO3,至少含有Ba(NO3)2和CaCl2中的一种
D.Ba(NO3)2、CaCl2、K2CO3都存在
难度: 中等查看答案及解析
-
硫代硫酸钠(Na2S2O3)可作为脱氯剂,已知25.0mL 0.100 mol·L-1的Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化为
A.SO32- B.SO42- C.S D.S2-
难度: 简单查看答案及解析