-
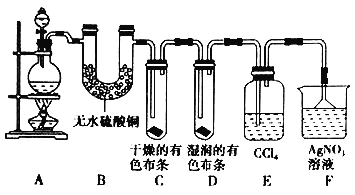
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700 ℃时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,立即被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些“理解”,你认为其中错误的是( )
A.金刚石属于金属单质 B.制造过程中元素种类没有改变
C.CCl4是一种化合物 D.这个反应是置换反应
难度: 中等查看答案及解析
-
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应:Al2O3+N2+3C ═ 2AlN+3CO合成.下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1mol AlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.上述反应中,氧化产物与还原产物的物质的量之比为2:3
难度: 中等查看答案及解析
-
人体血红蛋白中含有Fe2+,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转变为Fe3+,生成高铁血红蛋白而丧失与O2结合的能力,服用维生素C可缓解亚硝酸盐的中毒。下列说法正确的( )
A.亚硝酸盐表现出还原性 B.维生素C可被亚硝酸盐氧化
C.维生素C表现出氧化性 D.中毒时亚硝酸盐被Fe2+氧化成硝酸盐
难度: 简单查看答案及解析
-
在甲、乙两烧杯溶液中,共含有大量的Cu2+、K+、H+、NO3-、CO32-、OH-。已知两烧杯中各含三种离子,且甲烧杯的溶液呈蓝色,则乙烧杯中大量存在的离子是( )
A.Cu2+、H+、NO3- B.K+、CO32-、OH-
C.CO32-、OH-、NO3- D.K+、H+、NO3-
难度: 中等查看答案及解析
-
下列粒子既有氧化性又有还原性的是( )
A.Mg B.Na+ C.Fe2+ D.Cl-
难度: 简单查看答案及解析
-
下列叙述中正确的是
A.含最高价元素的化合物,一定具有强氧化性
B.阳离子只有氧化性,阴离子只有还原性
C.失去电子多的还原剂还原性强
D.化学反应中,某元素由化合态变为游离态,此元素可能被氧化
难度: 简单查看答案及解析
-
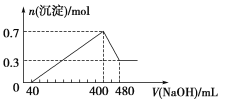
在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量之比为3∶2∶1,现加入适量铁粉,使溶液中三种离子的物质的量之比变为1∶2∶4,则参加反应的铁粉与原溶液中Fe3+的物质的量之比为( )
A.2∶1 B.1∶2 C.1∶3 D.1∶4
难度: 困难查看答案及解析
-
只用一种试剂鉴别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )
A.Ba(OH)2 B.H2SO4 C.NaOH D.AgNO3
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓
C.三氯化铁溶液中加入铜粉:2Fe3++3Cu=2Fe+3Cu2+
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
难度: 中等查看答案及解析
-
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是
A.氢氧化钠与盐酸,;氢氧化钠与碳酸
B.BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
C.Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液
D.石灰石与硝酸反应;石灰石与盐酸
难度: 简单查看答案及解析
-
下列除杂质的方法不正确的是
A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B.FeCl3溶液中混有少量AlCl3:加入过量的氨水,过滤洗涤沉淀,将沉淀再用适量盐酸溶解
C.Fe2O3中混有少量Al2O3:加入过量NaOH溶液充分反应,过滤、洗涤、干燥
D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
难度: 中等查看答案及解析
-
我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe+CuSO4═Cu+FeSO4。有关该反应的说法正确的是( )
A.Fe是氧化剂 B.氧化性:Fe>Cu
C.当生成32gCu时转移1mol电子 D.CuSO4发生氧化反应
难度: 简单查看答案及解析
-
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是 ( )
A.在水中形成的分散系能产生丁达尔现象
B.“钴酞菁”分子既能透过滤纸,也能透过半透膜
C.分子直径比钠离子小
D.在水中所形成的分散系属悬浊液
难度: 简单查看答案及解析
-
高一学生小强的化学笔记中有如下内容:
①纯净物按照组成可以分为单质和化合物;
②单质又可分为金属单质和非金属单质;
③无机化合物主要包括:酸、碱、盐和氧化物;
④按照分散剂粒子直径大小可将分散系分为溶液、浊液和胶体;
⑤电解质就是在水溶液中能导电的化合物;
⑥氧化还原反应的特征是化合价升降;
你认为他的笔记中有几处错误 ( )
A.两处 B.三处 C.四处 D.五处
难度: 简单查看答案及解析
-
用NA 表示阿伏加德罗常数,下列叙述正确的是( )
A.常温常压下,4gH2含有的分子数为2NA
B.17g氨气所含电子数目为8NA
C.将1体积c1mol/L的硫酸溶于4体积水中 ,稀溶液的浓度为0.2c1mol/L
D.将5.85gNaCl 晶体溶入100mL水中,制得0.1mol/L的NaCl溶液
难度: 中等查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断不正确的是
A. 生成44.8L N2(标准状况)
B. 有0.25 mol KNO3被还原
C. 转移电子的物质的量为1.75mol
D. 被氧化的N原子的物质的量为3.75mol
难度: 困难查看答案及解析
-
下列我国古代的技术应用中,不涉及氧化还原反应的是
A. 煅烧贝壳
 B. 粮食酿醋
B. 粮食酿醋
C. 古法炼铁
 D. 火药爆炸
D. 火药爆炸
难度: 简单查看答案及解析
-
最近,科学家开发出一种低成本光伏材料——蜂窝状石墨烯。生产原理是:
Na2O + 2CO
Na2CO3 + C(石墨烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是( )
A.该生产石墨烯的反应属于氧化还原反应
B.石墨烯与金刚石互为同素异形体
C.Na2O属于碱性氧化物,CO属于酸性氧化物,Na2CO3属于盐
D.自然界中碳元素有游离态和化合态两种存在形式
难度: 中等查看答案及解析
-
同温同压下,相同质量的铝片分别与足量的盐酸和氢氧化钠溶液反应,下列说法正确的是( )
A. 盐酸产生气体的体积大
B. 盐酸产生气体的体积小
C. 产生气体的体积相等
D. 消耗氢氧化钠的物质的量多
难度: 中等查看答案及解析
-
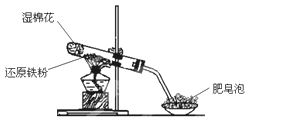
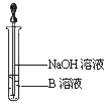
下列图示中能较长时间看到Fe(OH)2白色沉淀的有( )

A.Ⅰ、Ⅱ、Ⅲ B.Ⅰ、Ⅱ、Ⅳ C.Ⅰ、Ⅲ、Ⅳ D.Ⅰ、Ⅱ、Ⅲ、Ⅳ
难度: 中等查看答案及解析