-
对中国古代著作涉及化学的叙述,下列解读错误的是( )
A. 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是K2CO3
B. 《黄白第十六》中“曾青涂铁,铁赤如铜”,“ 曾青”是指可溶性铜盐
C. 《天工开物》中“凡石灰,经火焚炼用”里的“石灰”指的是Ca(OH)2
D. 《汉书》中“高奴县有洧水可燃”这里的“洧水”指的是石油
难度: 简单查看答案及解析
-
港珠澳大桥建设过程使用了下列各种材料,其中属于无机材料的是( )

A.高强度耐腐蚀钢筋
B.超高分子量聚乙烯纤维
C.大尺寸橡胶隔震支座
D.高韧薄层沥青罩面
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,124 g P4中所含P—P键数目为4NA
B.100 mL 1mol·L−1FeCl3溶液中所含Fe3+的数目为0.1NA
C.密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
D.标况下,11.2 L甲烷和乙烯的混合气体充分燃烧,所形成的O—H键数目为2NA
难度: 简单查看答案及解析
-
化学反应条件的变化会影响化学反应产物或现象。下列有关影响因素的分析,错误的是( )
选项
反应物
反应产物或现象
影响因素
A
Ca(OH)2溶液、CO2
现象不同
CO2的用量
B
Cu、HNO3
NO或NO2
HNO3的浓度
C
Na、O2
Na2O或Na2O2
O2用量
D
AlCl3溶液、NaOH溶液
现象不同
试剂加入顺序
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列实验现象、结论及其推理都正确的是 ( )
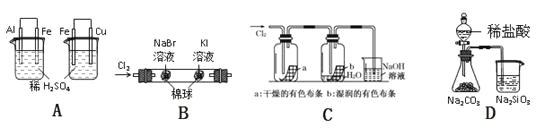
实验
实验现象
结论
A
左烧杯中铁不断溶解,右烧杯中铁表面有气泡
活动性:Al>Fe>Cu
B
左边棉花变为橙色,右边棉花变为蓝色
氧化性:Cl2>Br2>I2
C
a中布条不褪色,b中布条褪色
干燥氯气无漂白性,潮湿的氯气有漂泊性
D
锥形瓶中有气体产生,烧杯中液体变浑浊
非金属性:Cl>C>Si
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
有机物
 俗称稗草烯,主要用于水稻田防除稗草。下列有关该有机物的说法正确的是( )
俗称稗草烯,主要用于水稻田防除稗草。下列有关该有机物的说法正确的是( )A.属于烯烃
B.可用
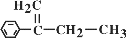 与Cl2在光照条件下反应直接制得纯净的该物质
与Cl2在光照条件下反应直接制得纯净的该物质C.不能使酸性高锰酸钾溶液褪色
D.在一定条件下可发生聚合反应
难度: 简单查看答案及解析
-
X、Y、Z、Q、R均为短周期元素(原子序数Y<X<R<Q<Z)。25℃时,其最高价氧化物的水化物溶液(浓度均为0.001mol/L)的pH和原子半径的关系如图所示。下列说法中正确的是( )
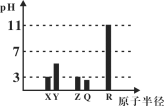
A.X和R的简单离子半径:X < R
B.Z、Q的气态氢化物的稳定性:Z > Q
C.Z的最高价氧化物对应水化物的化学式为HZO3
D.上述五种元素中有两种元素是金属元素
难度: 中等查看答案及解析
-
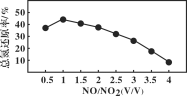
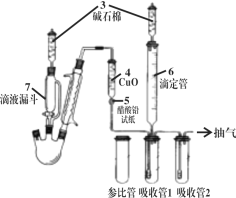
已知Ca3N2遇水发生水解反应,需密封保存。利用如下装置制取氮气,并用氮气制备Ca3N2,下列说法正确的是 ( )
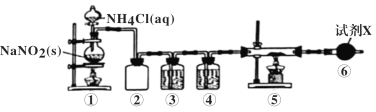
A.①中发生的反应属于置换反应
B.②的作用为安全瓶,防止停止加热时①中的溶液进入③中
C.③、④、⑥中依次盛装浓H2SO4、酸性氯化亚铁溶液、碱石灰
D.取⑤中少量产物,加适量蒸馏水,再滴加石蕊试液,溶液显蓝色
难度: 中等查看答案及解析
-
研究小组向恒容密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)
D(g)+E(g)。已知∆c=c后-c前,下列示意图中,能正确表达该反应的有关物理量随时间变化的是( )
A.
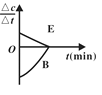 B.
B.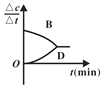 C.
C.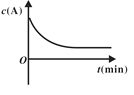 D.
D.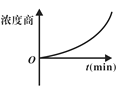
难度: 中等查看答案及解析
-
下列有关“石油
分馏产品
乙烯
CH2BrCH2Br
CH2OHCH2OH”转化的描述中,正确的是( )
A.步骤①②均没有化学键断裂 B.CH2OHCH2OH不能发生酯化反应
C.C2H4Br2与C2H2Br4 有相同数目的同分异构体 D.步骤④属于加成反应
难度: 简单查看答案及解析
-
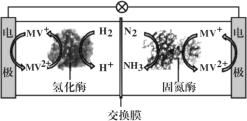
三室式电渗析法处理含NH4NO3废水的原理如图所示,工作一段时间后,在两极区均得到副产品NH4NO3。下列叙述错误的是( )
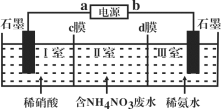
A.a极为电源负极,b极为电源正极
B.c膜是阳离子交换膜,d膜是阴离子交换膜
C.阳极电极反应式为4OH--4e-=O2↑+2H2O
D.Ⅱ室溶液的pH保持不变
难度: 中等查看答案及解析
-
氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是
A.HCl和HIO B.HI和HClO C.HClO3和HIO D.HClO和HIO
难度: 简单查看答案及解析
-
某兴趣小组用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到如图所示曲线。下列分析错误的是( )
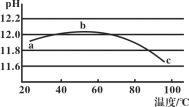
A.b点水解程度最大
B.水的电离平衡也会对溶液的pH产生影响
C.a→b段水解平衡向右移动
D.水解是吸热过程
难度: 中等查看答案及解析
-
25℃时,FeS、CuS的溶度积常数分别为6.3×10-18 mol2·L-2、1.3×10-36 mol2·L-2。下列说法中,错误的是( )
A.25℃时,FeS的溶解度大于CuS的溶解度
B.反应CuSO4+H2S=CuS↓+H2SO4不能发生
C.可用FeS作沉淀剂除去废水中的Cu2+
D.25℃时,饱和CuS溶液中,Cu2+的浓度为
×10-18 mol·L-1
难度: 中等查看答案及解析