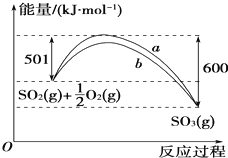
-
pH=11 的 NaOH溶液和 pH=3的醋酸溶液以等体积混合后,所得溶液中 c(Na+ )、 c(CHCOO -) 的正确关系是( )
A. c(Na+ )> c(CHCOO -) B. c(Na+ )= c(CHCOO -)
C. c(Na+ )< c(CHCOO -) D. 不能确定
难度: 简单查看答案及解析
-
能在溶液中大量共存的一组离子是
A. NH4+、Ag+、PO43-、Cl- B. Fe3+、H+、I-、HCO3-
C. K+、Na+、NO3-、MnO4- D. Al3+、Mg2+、SO42-、CO32-
难度: 中等查看答案及解析
-
已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是( )
A. X的能量一定低于M的,Y的能量一定低于N的
B. 因为该反应为吸热反应,故一定要加热反应才能进行
C. 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D. X和Y的总能量一定低于M和N的总能量
难度: 简单查看答案及解析
-
将0.1 mol·L-1醋酸溶液加水稀释,下列说法正确的是( )
A.溶液中c(OH-)和c(H+)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
难度: 中等查看答案及解析
-
原电池的正极所发生的反应及得失电子情况是( )
A.氧化反应、得电子 B.还原反应、失电子
C.氧化反应、失电子 D.还原反应、得电子
难度: 简单查看答案及解析
-
沼气是一种能源,它的主要成份是CH4,0.5molCH4完全燃烧生成CO2和H2O时,放出445kJ热量,则下列热化学方程式中正确的是( )
A. 2CH4(g)+4O2(g) =2CO2(g)+4H2O(l) △H=+890kJ•moI-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=+890kJ•moI-1
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ•moI-1
D. 1/2CH4(g)+O2(g)=1/2CO2(g)+2H2O(l) △H=-890kJ•mo1-1
难度: 中等查看答案及解析
-
已知下列热化学方程式:
Zn(s) + 1/2 O2(g)= ZnO(s) ΔH= -351.1 kJ·mol-1①
Hg(l) + 1/2 O2(g)= HgO(s) ΔH= -90.7 kJ·mol-1 ②
由此可知Zn(s)+ HgO(s)= ZnO(s)+ Hg(l)的反应热ΔH为
A. -260.4 kJ·mol-1 B. +260.4 kJ·mol-1 C. - 441.8 kJ·mol-1 D. + 441.8 kJ·mol-1
难度: 简单查看答案及解析
-
下列反应在常温下均为非自发反应,则在高温下仍为非自发的是
A.2CO(g)=2 C(s)+ O2(g)
B.2CuO(s)=Cu2O(s)+1/2O2(g)
C.MgCO3(s)=MgO(s)+CO2 (g)
D.SnO2(s)+C(s)=Sn(s)+CO2 (g)
难度: 简单查看答案及解析
-
已知反应:3A + 4B
C + 2D 其反应速率可以分别用V(A)、V(B)、V(C)、V(D)[mol/(L·min)]表示,则正确的关系是
A.V(A)=
V(C) B.V(B)=
V(A)
C.V(C)=4V(B) D.V(D)=
V(C)
难度: 简单查看答案及解析
-
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )
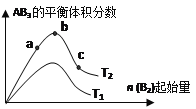
A.反应速率a>b>c
B.达到平衡时,AB3的物质的量大小为:b > c > a
C.若T2>T1,则正反应一定是吸热反应
D.达到平衡时A2的转化率大小为:b>a>c
难度: 中等查看答案及解析
-
在2L 密闭容器中充有2 mol SO2和一定量的O2,发生下列反应2SO2+O22SO3,假设反应过程中温度恒定,当反应进行到4 min时,测得SO2为0.4 mol,若反应进行到2 min时,密闭容器中SO2的物质的量为
A. 1.6 mol B. 1.2 mol C. 大于1.6 mol D. 小于1.2 mol
难度: 简单查看答案及解析
-
CO2和H2的混和气体加热到1023K时,可建立下列平衡:CO2+H2
CO+H2O(g),在该温度下,平衡时有90%的氢气变成水蒸气(平衡常数K=1),则原混合气体中CO2和H2的分子数之比是( )
A.9:1 B.1:5 C.1:10 D.1:1
难度: 中等查看答案及解析
-
下列事实中,不能用勒夏特列原理解释的是( )
A.对熟石灰的悬浊液加热,悬浊液中固体质量增加
B.实验室中常用排饱和食盐水的方式收集氯气
C.打开汽水瓶,有气泡从溶液中冒出
D.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
难度: 简单查看答案及解析
-
下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
B.0.1 mol/L NH4Cl溶液:c(NH4+)=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-)
难度: 中等查看答案及解析
-
在pH=1的无色溶液中能大量共存的离子组是
A.NH4+、Mg2+、SO42-、Cl- B.Ba2+、K+、OH-、NO3-
C.Al3+、Cu2+、SO42-、Cl- D.Na+、Ca2+、Cl-、AlO2-
难度: 简单查看答案及解析
-
pH=13的 强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为
A.9:1 B.1:11 C.1:9 D.11:1
难度: 简单查看答案及解析
-
下列物质的稀溶液中,溶质的阴、阳离子个数之比为1∶2的是
A.Na2HPO4 B.NaHSO4 C.(NH4)2SO4 D.K2S
难度: 简单查看答案及解析
-
关于小苏打水溶液的表述正确的是( )
A.c(Na+) = c(HCO3-) + c(CO32-) + c(H2CO3)
B.c(Na+)+c(H+) = c(HCO3-) + c(CO32-) + c(OH-)
C.HCO3-的电离程度大于HCO3-的水解程度
D.存在的电离有:NaHCO3 = Na++ HCO3- ,HCO3- = H++ CO32-
难度: 中等查看答案及解析
-
在密闭容器中进行的下列反应:M(g)+N(g)
R(g)+2L,此反应符合下图。下列叙述正确的是

A.正反应吸热,L是气体
B.正反应吸热,L是固体
C.正反应放热,L是气体
D.正反应放热,L是固体或液体
难度: 中等查看答案及解析
-
下列物质的水溶液能导电,但属于非电解质的是( )
A.CH3CH2COOH B.Cl2 C.NH4HCO3 D.SO2
难度: 简单查看答案及解析
-
从下列现象可以判断某一元酸是强酸的是( )
A.加热该酸至沸腾也不分解
B.该酸可以与石灰石反应放出CO2
C.该酸可以把Al(OH)3沉淀溶解
D.该酸浓度为0.1 mol·L-1时的pH为1
难度: 中等查看答案及解析
-
常温下某溶液中由水电离产生的c(H+)=1×10-5mol·L-1,则下列叙述正确的是
A.pH值为5 B.一定是酸溶液
C.可能是强酸的酸式盐溶液 D.pH值可能为9
难度: 中等查看答案及解析
-
下图为一原电池的结构示意图,下列说法中,不正确的是
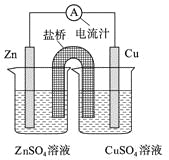
A.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu,该反应一定为放热反应
B.原电池工作时,Zn电极流出电子,发生氧化反应
C.原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深
D.如果将Cu电极改为Fe电极,Zn电极依然作负极
难度: 简单查看答案及解析