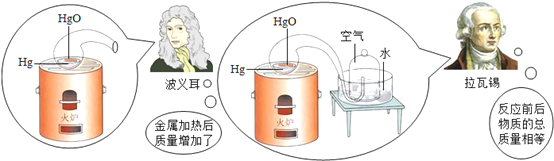
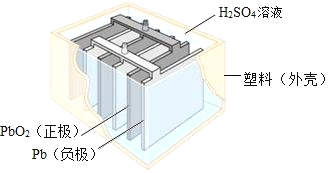
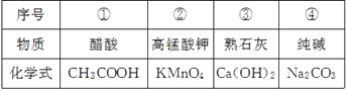
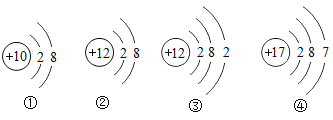
-
下列变化属于化学变化的是( )
A. 冰雪融化 B. 湿衣晾干 C. 汽油挥发 D. 酒精燃烧
难度: 简单查看答案及解析
-
下列关于溶液的说法中正确的是
A. 均一稳定的液体都是溶液
B. 稀盐酸的溶质是盐酸
C. 溶液都有良好的导电性
D. 溶液加水稀释前后,溶质的质量不变
难度: 简单查看答案及解析
-
下列对资源的利用过程属于化学变化的是( )
A. 石油的蒸馏 B. 铁矿石炼铁
C. 太阳能发电 D. 分离液态空气
难度: 简单查看答案及解析
-
肉眼不能直接观察到水分子的原因是( )
A.分子的质量和体积都很小 B.分子不是真实存在的
C.分子在不断运动 D.分子间有间隔
难度: 简单查看答案及解析
-
下列有关物质用途的说法错误的是( )
A. 用熟石灰改良酸性土壤
B. 用食盐水除水垢
C. 用活性炭去除冰箱异味
D. 用碳酸氢钠治疗胃酸过多症
难度: 简单查看答案及解析
-
下列对实验现象的描述正确的是( )
A.用pH试纸测定酸溶液的pH,试纸由白色变为红色
B.铁丝在氧气中剧烈燃烧生成四氧化三铁
C.光亮的铁丝浸入稀盐酸,形成黄色溶液
D.木炭在氧气中燃烧,发出白光
难度: 中等查看答案及解析
-
下列对实验现象的描述正确的是( )
A. 碳在氧气中燃烧发出白光,生成二氧化碳
B. 镁在空气中燃烧发出耀眼的白光,生成白色固体
C. 细铁丝伸入氧气瓶中,剧烈燃烧,火星四射,生成黑色固体
D. 电解水,正负极产生的气体质量比为1:2
难度: 中等查看答案及解析
-
下列图示的实验基本操作正确的是( )
A.
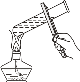 给试管中的液体加热 B.
给试管中的液体加热 B.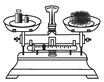 称量一定质量的食盐
称量一定质量的食盐C.
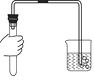 检查装置的气密性 D.
检查装置的气密性 D. 向试管中滴加液体
向试管中滴加液体难度: 简单查看答案及解析
-
我县在环保领域下重拳,制订了很多严格的政策措施,以保护碧水蓝天。下列做法中,违反环境保护政策的是()
A.执行机动车限号规定,减少汽车尾气排放 B.秋季收获甘薯实行集中加工,治理粉浆水污染
C.农户在自家承包地焚烧秸秆,增加土壤肥力 D.冬季推广使用洁净型煤清洁取暖
难度: 简单查看答案及解析
-
下列物质能在pH=1的溶液中共存且能形成有色溶液的是( )
A.(NH4)2SO4、FeCl3、NaNO3、K2SO4 B.KOH、KNO3、NaCl、KMnO4
C.MgSO4、NaCl、HNO3、K2CO3 D.Ba(OH)2、CuSO4、MgCl2、H2SO4
难度: 中等查看答案及解析
-
过氧化钠(Na2O2)能与二氧化碳反应生成碳酸钠和X,可表示如下:2Na2O2+2CO2=2Na2CO3+X↑,下列有关说法错误的是( )
A. Na2O2中氧元素化合价为-1价 B. CO2可用作气体肥料
C. Na2CO3可用于清洗厨房油污 D. 白磷与X反应生成大量白雾
难度: 中等查看答案及解析
-
将ag锌粉加到一定质量的Fe(NO3)2和AgNO3组成的某混合溶液中,充分反应后过滤,得到滤渣和滤液。下列有关说法中,不合理的是
A. 若滤渣为纯净物,则滤液中可能含有Ag+
B. 若滤渣中加入稀盐酸有气泡产生,则滤液此时可能为无色
C. 若滤液中加入氯化钠溶液无明显现象,则滤液此时最多含两种金属离子
D. 滤渣的质量一定大于ag
难度: 困难查看答案及解析
-
分析推理是化学学习常用的方法,下列分析推理正确的是( )
A.中和反应一定放热,所以放热反应一定是中和反应
B.单质由一种元素组成,所以由一种元素组成的物质一定是单质
C.酸溶液能与活泼金属反应,所以能与活泼金属反应的溶液一定是酸溶液
D.点燃可燃性气体前要验纯,所以点燃一氧化碳气体前要验纯
难度: 中等查看答案及解析
-
在日常生活中,如果将深颜色的衣服和浅颜色的衣服浸泡在一起,可能会使浅色的衣服染上深颜色.这其中的主要原因是由于深色染料中的( )
A. 分子本身发生了变化 B. 分子在不断运动
C. 分子间有一定的间隔 D. 分子在化学变化中可分
难度: 简单查看答案及解析