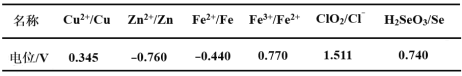-
清明上河图描绘了北宋都城的人世风物。下列有关说法错误的是

A.刀剪铺里的铁器是合金制品
B.木质拱桥的材料属于有机高分子材料
C.酒香中含有酯类物质
D.布坊中丝绸的主要成份是纤维素
难度: 简单查看答案及解析
-
对乙酰氨基酚是一种常用的退热和止痛药物,可通过下图路线合成,下列说法正确的是
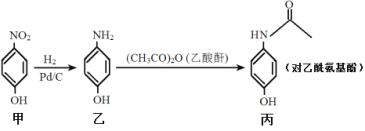
A.丙的分子式为C8H10NO2
B.乙分子中的所有原子一定共平面
C.甲的苯环上的一氯代物有2种
D.由乙制备丙的反应类型为加成反应
难度: 中等查看答案及解析
-
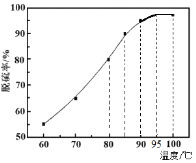
W、X、Y、Z均为短周期元素且原子序数依次增大,W和X同族。Y原子最外层电子数是W与X原子最外层电子数之和的3倍,是Z原子最外层电子数的2倍。下列说法正确的是
A.离子半径:W-<X+
B.Z的最高价氧化物的水化物是强碱
C.化合物XZW4具有强还原性
D.W与Y只能形成10电子化合物
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.标准状况下,22.4 L CH2Cl2中含有碳原子数为NA
B.在溶有1molFe(OH)3的胶体中含有的胶粒数小于NA
C.常温下0.2 mol铝与足量浓硫酸反应,生成气体的分子数为0.3 NA
D.常温下向密闭容器内充入46 g NO2,容器中气体的分子数为NA
难度: 中等查看答案及解析
-
近日,科学家发表了高温二氧化碳电解发展报告,利用固体氧化物电解池将CO2和H2O转化为合成气并联产高纯度O2。原理如图所示。下列说法正确的是
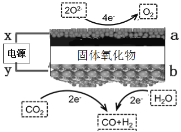
A.x极为电源正极
B.当有2 mol电子流向a极时,产生0.5 molO2
C.b极CO2的反应式:CO2+2H++2e-=CO+H2O
D.电解质中阴离子由a向b移动
难度: 中等查看答案及解析
-
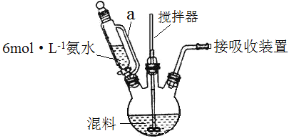
某实验小组将废铁屑(含硫化亚铁等杂质)和稀硫酸加入锥形瓶中,加热,充分反应,冷却后加入氨水,制得硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O],装置如下图(夹持仪器略去)。下列说法或操作错误的是
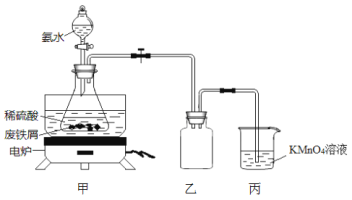
A.乙装置是安全瓶
B.将氨水滴入时,先缓慢打开活塞,再打开玻璃塞
C.KMnO4溶液的作用是吸收H2S等尾气,防止污染空气
D.锥形瓶中发生中和反应的离子方程式:NH3·H2O+H+=NH4++H2O
难度: 中等查看答案及解析
-
利用手持技术探究氢氧化铝制备实验电导率(电导率越大表示导电能力越强)的变化,浓度均为0.5 mol·L-1 的氢氧化钠和氨水分别滴定0.01 mol·L-1硫酸铝溶液,电导率变化曲线如图所示,下列说法错误的是
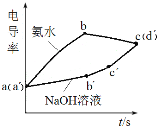
A.a(a´)点溶液pH<7
B.bc段电导率下降是因为生成了Al(OH)3沉淀
C.a´b´段和b´c´段使用碱的体积比约为3:1
D.b点溶液:c(H+)<2c(SO42-)+c(OH-)
难度: 中等查看答案及解析