-
下列既属于氧化还原反应,又属于吸热反应的是
A.铝片与稀盐酸反应
B.氢氧化钡与氯化铵的反应
C.灼热的碳与水蒸气的反应
D.铝热反应
难度: 简单查看答案及解析
-
下列说法正确的是
A.浓度不影响反应活化能,但能增大单位体积内活化分子百分数,从而增大反应速率
B.单位时间内有效碰撞的次数越多,化学反应速率越快
C.不存在活化能为0的化学反应
D.对于化学反应来说,反应速率越大,反应现象越明显
难度: 简单查看答案及解析
-
一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)
C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是
①混合气体的密度不再变化时 ②容器内气体的压强不再变化时 ③混合气体的总物质的量不再变化时 ④B的物质的量浓度不再变化时 ⑤混合气体的平均相对分子质量不再变化时 ⑥v正(B)=2v逆(C)时
A.①④⑤⑥ B.②③⑥ C.②④⑤⑥ D.只有④
难度: 中等查看答案及解析
-
已知:①Zn(s)+
O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
②2Ag(s)+
O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为
A. 2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)ΔH=-634.6 kJ·mol-1
B. Zn+Ag2O===ZnO+2Ag ΔH=+317.3kJ·mol-1
C. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=-317.3kJ
D. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=+317.3kJ·mol-1
难度: 中等查看答案及解析
-
下列实验事实不能用平衡移动原理解释的是( )
A.工业合成氨反应中加压有利于提高氨气的产率
B.将NO2球浸泡在冷水和热水中
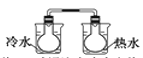
C.红棕色的NO2 ,加压后颜色先变深后变浅
D.
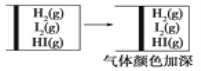
难度: 简单查看答案及解析
-
汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体,反应方程式为4CO(g)+2NO2(g)
4CO2(g)+N2(g) ΔH=-1200kJ·mol-1。对于该反应,温度不同(T2>T1)其他条件相同时,下列图像正确的是
A.
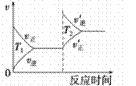 B.
B.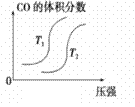 C.C
C.CD.
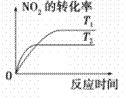
难度: 中等查看答案及解析
-
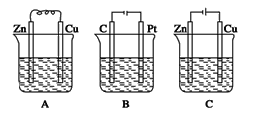
下图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法正确的是
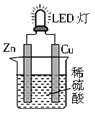
A. 锌是负极,电子流向为“锌片→LED灯→铜片→稀H2SO4→锌片”
B. 如果将硫酸换成橙汁,LED 灯不能发光
C. 氢离子在铜片表面被还原
D. 该电源工作时,烧杯中阳离子向Zn极移动,且c(H+)减小,c(Cu2+)增大
难度: 简单查看答案及解析
-
如图所示的装置用石墨电极电解饱和食盐水(两极均滴酚酞),以下说法正确的是
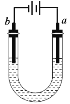
A. a电极附近溶液酸性减弱
B. a电极上发生还原反应
C. b电极附近酚酞变红
D. b电极上有黄绿色气体产生
难度: 中等查看答案及解析
-
按下图装置进行实验,若X轴表示流入阴极的电子的物质的量,则y轴不能表示( )
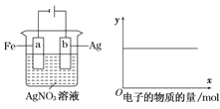
A.c(Ag+) B.c(NO3-) C.溶液的pH D.a棒的质量
难度: 中等查看答案及解析
-
一定温度下,在三个体积均为1.0 L的恒容密闭容器中,反应2H2(g)+CO(g)
CH3OH(g)达到平衡。下列说法不正确的是
容器
温度/K
起始浓度/(mol/L)
平衡浓度/(mol/L)
H2
CO
CH3OH
CH3OH
①
400
0.20
0.10
0
0.08
②
400
0.40
0.20
0
X
③
500
0
0
0.10
0.025
A.X = 0.16 B.该反应的正反应是放热反应
C.平衡时的反应速率:②>① D.400 K 时该反应平衡常数的值为2500
难度: 中等查看答案及解析
-
对于恒定容积的密闭容器中进行的反应A(s)+B(g)
2C(g) ΔH<0,平衡后只改变下列条件,有关叙述正确的是
A. 加入少量A物质,平衡正向移动,正反应速率加快
B. 加入少量B物质,平衡正向移动,逆反应速率减小
C. 充入氩气(不参加反应),平衡逆向移动,逆反应速率加快
D. 升高温度,平衡逆向移动,正反应速率和逆反应速率都加快
难度: 中等查看答案及解析
-
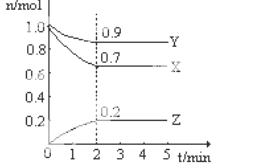
一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g)
4NO2(g)+ O2(g),反应吸热。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )
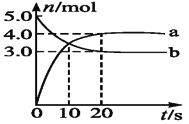
A.10min时,反应达到平衡
B.曲线a表示NO2的物质的量随反应时间的变化
C.0~20min内平均反应速率v(N2O5)=0.1mol∙L-1∙min-1
D.达到平衡时,N2O5的转化率为60%
难度: 中等查看答案及解析
-
在一定条件下,将 1mol A投入体积为1 L的密闭容器中,发生如下反应:2A(g)
B(g) + xC(?),(正反应放热)。经t min后反应达到平衡,此时A的转化率为a,容器内压强变为原来的(1+1.5a)倍,则下列说法中正确的是( )
A.C为气态或液态物质
B.x = 3
C.x =4
D.降温可降低A的转化率
难度: 简单查看答案及解析
-
研究表明,化学反应的能量变化与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
化学键
P—P
P—O
O=O
P=O
键能
kJ/mol-1
197
360
499
X
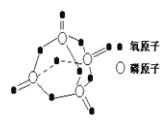
已知白磷的燃烧方程式为:P4(s)+5O2(g)P4O10(s),该反应放出热量2379.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如图所示,则上表中X为
A.434 B.335 C.237 D.188
难度: 简单查看答案及解析
-
有A、B、C、D四块金属片,进行如下实验:
①A、B用导线相连后,同时浸入稀H2SO4中, A上有气泡产生;
②C、D用导线相连后,同时浸入稀H2SO4中, D发生还原反应
③A、C用导线相连后,同时浸入稀H2SO4中,电子流动方向由A→导线→C。
据此判断四种金属的活动性顺序为( )
A.C>D >A>B B.C>A> D>B C.B>A>C>D D.B>D>C>A
难度: 简单查看答案及解析
-
被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O
ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当65g Zn完全溶解时,流经电极的电子为1mol
D.电池正极反应式为2MnO2+2e-+2H2O
2MnO(OH)+2OH-
难度: 中等查看答案及解析
-
如图所示各烧杯中盛有海水,铁在其中被腐蚀,腐蚀的速率由快到慢的顺序为
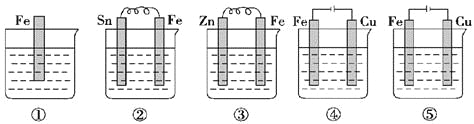
A.⑤②①④③ B.③②⑤④①
C.⑤④③②① D.⑤②①③④
难度: 中等查看答案及解析
-
据媒体报道,以氢氧燃料电池为动力的公交车即将在北京试运行。质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是
①正极反应为:O2+4H++4e- ═2H2O
②负极反应为:2H2-4e- ═4H+
③总的化学反应为:2H2+O2
2H2O
④H+通过电解质向正极移动
A.①②③④ B.②③④ C.①②④ D.①②③
难度: 中等查看答案及解析
-
能够使反应Cu+2H2O=Cu(OH)2+H2↑发生的是( )
A.铜片作原电池的负极,石墨作原电池的正极,氯化钠溶液做电解质溶液
B.铜锌合金在潮湿空气中发生电化学腐蚀
C.用铜片作阴、阳电极,电解硫酸钠溶液
D.用铜片作阴、阳电极,电解硫酸铜溶液
难度: 中等查看答案及解析
-
如图所示的装置中,a、b都是惰性电极,通电一段时间后,b电极附近溶液呈红色.下列说法中正确的是( )
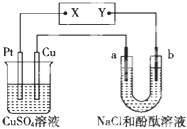
A.X是负极,Y是正极 B.Pt是阴极,Cu是阳极
C.CuSO4溶液的酸性逐渐增强 D.CuSO4溶液的酸性不变
难度: 中等查看答案及解析