-
已知吸热反应2CO(g) = 2C(s) + O2(g),假设△H和△S不随温度而变,下列说法中正确的是( )
A. 低温下能自发进行 B. 高温下能自发进行
C. 任何温度下都不能自发进行 D. 任何温度下都能自发进行
难度: 简单查看答案及解析
-
有a、b、c、d四种原子序数依次增大,且均不大于20的主族元素,a、c同主族,a的最外层电子数是内层电子数的3倍,b为金属元素,a、c、d的最外层电子数之和为19。下列叙述正确的是
A. a、b可能形成含有共价键的离子化合物
B. 简单离子半径大小:d>c>a>b
C. 含氧酸的酸性强弱:d>c
D. b、c的简单离子在水溶液中一定能大量共存
难度: 中等查看答案及解析
-
下列说法不正确的是
A.“霾尘积聚难见路人”,雾和霾所形成的气溶胶具有丁达尔效应
B.绿色化学的核心是利用化学原理从源头上减少或消除工业生产对环境的污染
C.“天宫二号”使用的碳纤维是一种新型有机高分子材料
D.丝绸的主要成分是蛋白质,属于天然高分子化合物
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A.78g苯含有的碳碳双键数为3NA
B.电解精炼铜时,若转移了NA个电子,则阳极质量减小32g
C.2.0gH218O与D2O的混合物中所含中子数为NA
D.1molN2与3molH2反生成的NH3分子数为2NA
难度: 中等查看答案及解析
-
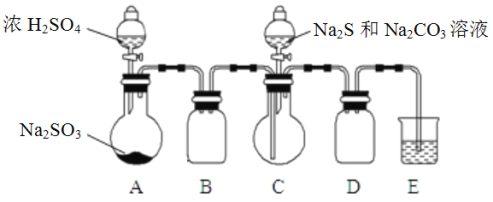
下列药品和装置合理且能完成相应实验的是( )
A.
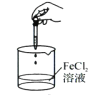 制备氢氧化亚铁
制备氢氧化亚铁B.
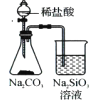 验证非金属性Cl >C >Si
验证非金属性Cl >C >SiC.
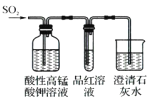 检验二氧化硫中是否混有二氧化碳
检验二氧化硫中是否混有二氧化碳D.
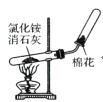 实验室制取并收集氨气
实验室制取并收集氨气难度: 简单查看答案及解析
-
室温下,下列各组离子能大量共存的是
A.稀硫酸中:K+、Mg2+、
、
B.KW/c(H+)=10−13 mol·L−1的溶液中:Fe3+、
、Mg2+、
C.NaHS溶液中:
、K+、C1−、Cu2+
D.通入大量CO2的溶液中:Na+、ClO−、CH3COO−、
难度: 困难查看答案及解析
-
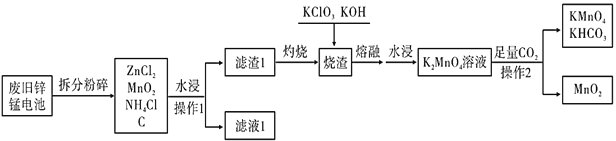
MnO2是一种重要的无机功能材料,可由MnSO4和NaClO3溶液反应制得,反应原理为: MnSO4+ NaClO3+ H2O
Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),则关于此反应的叙述不正确的是
A.NaClO3中Cl的化合价为+5
B.每生成8.7 g氧化产物,反应中转移的电子数约为0.2×6.02×1023
C.NaClO3的氧化性强于MnO2的氧化性
D.该反应右边方框内的产物是NaOH
难度: 困难查看答案及解析
-
一定条件下,通过下列反应可实现燃煤烟气中的硫的回收:SO2(g)+2CO(g)
2CO2(g)+S(l) ΔH<0。一定温度下,在容积为2L的恒容密闭容器中,1molSO2和nmolCO发生反应,2min后达到平衡,生成2amolCO2。下列说法中正确的是( )
A.反应前2min的平均速率υ(SO2)=0.1amol/(L·min)
B.当混合气体的物质的量不再改变时,反应达到平衡状态
C.平衡后保持其他条件不变,从容器中分离出部分硫,平衡向正反应方向移动
D.平衡后保持其他条件不变,升高温度和加入催化剂,SO2的转化率均增大
难度: 中等查看答案及解析
-
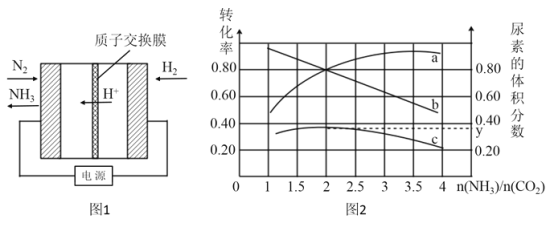
用酸性氢氧燃料电池电解粗盐水(含Na+、Cl-和少量Mg2+、Br-)的装置如图所示(a、b均为石墨电极),下列说法正确的是
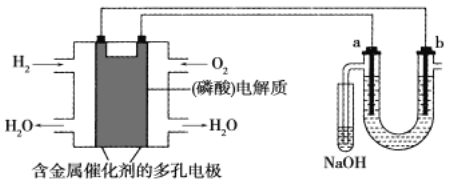
A.电池工作时,负极反应式为:H2-2e-+2OH-=2H2O
B.当电池中消耗2.24 L(标准状况下)H2时,b极周围会产生0.1 mol气体
C.电解过程中电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.a极的电极反应式为:2H++2e-=H2↑
难度: 困难查看答案及解析
-
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是

A. 反应中转移电子的物质的量是0.21 mol
B. ClO
的生成可能是由于温度升高引起的
C. 标准状况下有3.36 L氯气参加反应
D. 苛性钾溶液中KOH的物质的量为0.2 mol
难度: 简单查看答案及解析
-
下列各反应对应的离子方程式正确的是
A.向100 mL 0.12 mol·L−1的Ba(OH)2溶液中通入0.02 mol CO2: Ba2++3OH−+2CO2=
+BaCO3↓+H2O
B.向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2OH−+2
=
CaCO3↓+
+2H2O
C.硫酸氢钠与氢氧化钡两种溶液反应后溶液恰好呈中性:H++
+Ba2++OH−=BaSO4↓+H2O
D.向含0.1 mol NaOH和0.2molNa2CO3的溶液中加入1L0.4 mol·L−1稀盐酸:OH−+
+3H+=CO2↑+2H2O
难度: 困难查看答案及解析
-
在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在温度500℃时发生反应:CO2(g)+3H2(g)
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
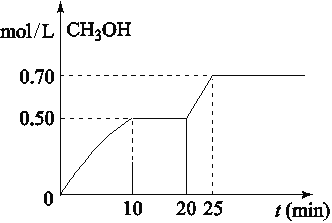
A. 从反应开始到10分钟时,H2的平均反应速率v(H2)=0.15 mol/(L·min)
B. 从20分钟到25分钟达到新的平衡,可能是增大压强
C. 其它条件不变,将温度升到800℃,再次达平衡时平衡常数减小
D. 从开始到25分钟,CO2的转化率是70%
难度: 中等查看答案及解析
-
某硫酸厂废气中SO2的回收利用方案如图所示,下列说法不正确的是
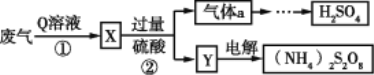
A.Q溶液是氨水
B.工业生产中气体a可通过两步反应转化为H2SO4
C.电解过程中被氧化的元素是硫
D.设计步骤①、②是为了富集SO2
难度: 中等查看答案及解析
-
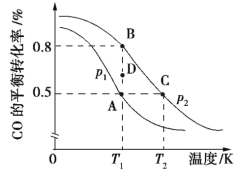
已知反应A2(?)+2B2(g)
2AB2(g) ΔH,在其他条件不变,改变某一条件时得到如下图象,下列对应图象叙述不正确的是

A.由图甲可知,A2为气体
B.由图甲可知,ΔH<0
C.由图乙可知,T=T0 ℃时,该可逆反应达到平衡状态
D.由图丙可知,t=t0时,改变的条件可能是增加了B2的量
难度: 中等查看答案及解析
-
少量铁片与100mL0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O;②加KNO3溶液;③滴入几滴浓盐酸;④加入少量铁粉;⑤加NaCl溶液;⑥滴入几滴硫酸铜溶液;⑦升高温度(不考虑盐酸挥发); ⑧改用10mL0.1mol/L盐酸
A. ③④⑥⑦⑧ B. ③⑤⑧ C. ③⑦⑧ D. ①⑥⑦
难度: 中等查看答案及解析