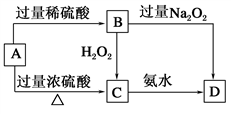
-
下列说法不正确的是( )
A. pH在5.6~7.0之间的降水通常称为酸雨
B. 燃煤时加入适量石灰石,可减少废气中SO2的量
C. 雷雨天气时空气中能生成少量的氮氧化物
D. 氮的氧化物是形成光化学烟雾的主要物质
难度: 简单查看答案及解析
-
下列化合物的用途叙述正确的是( )
A. 光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材枓主要是SiO2
B. 用硫磺粉处理洒落的金属汞
C. 高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性
D. SO2可用来漂白纸浆、毛、丝、草帽辫、增白食品等
难度: 简单查看答案及解析
-
取3张蓝色石蕊试纸放在玻璃上,然后按顺序分别滴加浓硝酸、浓硫酸、新制的氯水,3张试纸最后呈现的颜色是( )
A. 白、红、 白 B. 红、黑、红
C. 红、红、白 D. 白、黑、白
难度: 中等查看答案及解析
-
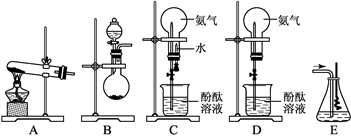
四支试管中分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生反应的现象如下图所示,其中充满NO2的试管是( )
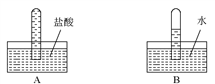
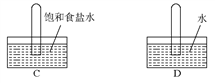
难度: 中等查看答案及解析
-
下列关于浓HNO3与浓H2SO4的叙述正确的是
A.常温下都可用锌制容器贮存 B.常温下都能与铜较快反应
C.露置于空气中,溶液质量均减轻 D.露置于空气中,溶液浓度均降低
难度: 中等查看答案及解析
-
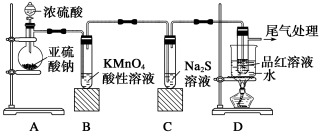
下列五种有色溶液与SO2作用均能褪色,其实质相同的是( )。
①品红溶液 ②酸性KMnO4溶液 ③溴水 ④滴有酚酞的NaOH溶液 ⑤含I2的淀粉溶液
A. ①④ B. ①②③
C. ②③⑤ D. ③⑤
难度: 中等查看答案及解析
-
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一,下列实验事实解释正确的是( )
现象
解释
A
KI淀粉溶液中通入Cl2溶液变蓝
Cl2能与淀粉发生显色反应
B
浓HNO3在光照条件下变黄
浓HNO3不稳定,生成有色产物溶于浓硝酸
C
将一定量的浓硫酸加入蔗糖,固体变黑膨胀
浓硫酸有吸水性和强氧化性
D
铝片放入浓硫酸中,无明显变化
说明铝在冷的浓硫酸中不反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
除去下列物质中的少量杂质(括号内的物质为杂质),所选用的试剂或方法不正确的是( )
A. CO2(SO2):饱和酸性KMnO4溶液 B. Cl2(HCl):饱和NaCl溶液
C. CO2(HCl):饱和NaHCO3溶液 D. SO2(HCl):饱和Na2SO3溶液
难度: 中等查看答案及解析
-
如下图,利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )
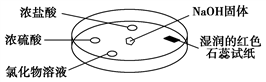
选项
实验现象
解 释
A
浓盐酸附近产生白烟
NH3与浓盐酸反应产生了微小的NH4Cl晶体
B
浓硫酸附近无明显现象
NH3与浓硫酸不发生反应
C
氯化物溶液变浑浊
该溶液一定是AlCl3溶液
D
湿润的红色石蕊试纸变蓝
NH3是一种可溶性碱
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
A. 标准状况下,0.5molSO3的体积约为11.2L
B. 3molNO2跟水完全反应,转移的电子数为2NA
C. 足量Cu跟含2molH2SO4的浓硫酸反应完全反应,转移的电子数为2NA
D. 标准状况下,5.6 L NO和5.6 LO2混合后的气体中含有的分子数为0.5NA
难度: 中等查看答案及解析
-
下列对于某些离子的检验及结论一定正确的是( )
A. 加入盐酸产生无色气体,将气体通入石灰水中,溶液变浑浊,一定有CO32-
B. 向溶液中滴加酸化的Ba(NO3)2溶液出现白色沉淀,说明该溶液中一定有SO42-
C. 加入浓NaOH溶液,微热产生气体使湿润的红色石蕊试纸变蓝,则原溶液一定有NH4+
D. 某溶液加入CCl4,CCl4层显紫红色,证明原溶液中一定存在I-
难度: 中等查看答案及解析
-
下列在酸性溶液中能大量共存的离子组是( )
A. Fe2+、NO3-、Na+、Cl- B. S2-、Na+、NH4+、NO3-
C.
K+、Cl-、SO42-、Al3+ D. SO42-、K+、HCO3-、Cl-
难度: 中等查看答案及解析
-
下列化学反应的离子方程式正确的是( )
A. 在稀氨水中通入少量CO2:NH3·H2O+CO2===NH4++HCO3-
B. 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-===CaSO3↓+2HClO
C. 用稀HNO3溶解FeS固体:FeS+2H+===Fe2++H2S↑
D. 氯气通入氢氧化钠溶液中 Cl2 +2OH― = Cl― + ClO― + H2O
难度: 中等查看答案及解析
-
向200 mL 2 mol·L-1 HNO3溶液中,逐渐加入铁粉至过量(假设生成的气体只有一种),在此过程中,n(Fe2+)随n(Fe)变化如右图所示。下列有关说法正确的是
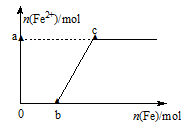
A.该过程中产生标准状况下的氢气4.48 L
B.向c点处的反应液中加入稀盐酸后无明显现象
C.图中a=1.5、b =1.5
D.当加入铁粉n mol时(0.1<n<0.15),溶液中n(Fe3+)=(0.3-2n)mol
难度: 极难查看答案及解析
-
常温下将盛有10 mL NO2和10 mL NO的混合气体的试管倒立于水槽中并向其中通入O2,一段时间后,试管内还剩余2 mL气体,则通入O2的体积可能为( )
A. 8mL B. 8.5mL C. l0mL D. 10.5mL
难度: 困难查看答案及解析
-
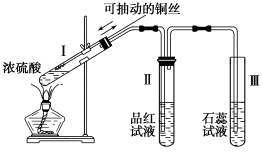
对金属锌与浓硫酸的反应来说,下列说法不当的是( )
A.若金属锌足量,反应所放出的气体应为混合物
B.反应消耗的锌的物质的量一定等于反应生成的气体的物质的量
C.反应中所转移的电子的物质的量一定等于反应生成的气体的物质的量2倍
D.由于金属铝的活动性强于锌,所以铝与浓硫酸的反应一定比锌与浓硫酸反应剧烈
难度: 中等查看答案及解析