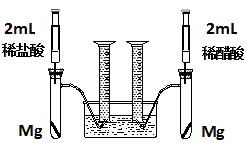
-
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是
A.由mXa+与nYb-得,m+a = n-b
B.X2-的还原性一定大于Y-
C.X、Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
难度: 简单查看答案及解析
-
下表中评价合理的是
选项
化学反应及其离子方程式
评价
A
Fe3O4与稀硝酸反应:
2Fe3O4+18H+=6Fe3++H2↑+8H2O
正确
B
向碳酸镁中加入稀盐酸:
CO32-+2H+=CO2↑+H2O
错误,碳酸镁不应该写成离子形式
C
向硫酸铵溶液中加入氢氧化钡溶液:
Ba2++SO42-=BaSO4↓
正确
D
FeBr2溶液与等物质的量的Cl2反应:
2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2
错误,Fe2+与Br-的化学计量数之比应为1:2
难度: 简单查看答案及解析
-
类推的思维方法在化学学习与研究中常会产生错误的结论。因此类推出的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中正确的是
A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B.NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似
C.苯不能使酸性高锰酸钾溶液褪色,故苯的同系物也不能使酸性高锰酸钾溶液褪色
D.CO2通入Ca(ClO)2溶液生成CaCO3和HClO,SO2通入Ca(ClO)2溶液也生成CaSO3和HClO
难度: 简单查看答案及解析
-
用NA代表阿伏加德罗常数,下列表述正确的是
A.1L 0.5 mol·L-1 CuCl2溶液中含有Cu2+的个数为0.5NA
B.标况下,22.4L辛烷完全燃烧生成二氧化碳分子为8NA
C.1mol Na2O和1mol Na2O2晶体中离子总数均为3NA
D.1mol羟基中电子数为10 NA
难度: 简单查看答案及解析
-
氮化钠和氢化钙都是离子化合物,与水反应的化学方程式(末配平)如下:Na3N+H2O →NaOH +NH3 ,CaH2+H2O →Ca(OH)2 +H2。有关它们的叙述:①离子半径:Na+>N3->H+ ;②与水反应都是氧化还原反应;③与水反应后的溶液都显碱性;④与盐酸反应都只生成一种盐;⑤两种化合物中的阴阳离子均具有相同的电子层结构。其中正确的是
A.②③④⑤ B.①③⑤ C.②④ D.③
难度: 简单查看答案及解析
-
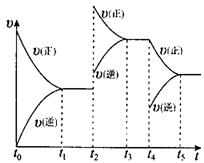
在某体积固定的密闭容器中进行如下可逆反应:A(g)+B(g)
2C(g),在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度关系如图所示。下列说法正确的是

A.此反应的正反应是吸热反应
B.反应在T1温度时达到平衡
C.T3温度时正反应速率大于逆反应速率
D.T3温度时正反应速率大于T1温度时正反应速率
难度: 简单查看答案及解析
-
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
A.60 mL B.45 mL C.30 mL D.15 mL
难度: 简单查看答案及解析
-
25°C时,下列关于分别由等体积0.1mol/L的2种溶液混合而成的溶液的说法中,不正确的是
A.Ba(OH)2溶液与Na2SO4溶液:pH=13
B.醋酸与CH3COONa溶液:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.Na2CO3溶液与NaOH溶液:c(Na+)>c(CO32-)>c(OH-)>c(H+)
D.Na2CO3溶液与NaHCO3溶液:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
难度: 简单查看答案及解析

 (R、R´为烃基)
(R、R´为烃基)