-
雌黄(As2S3)在我国古代常用作书写涂改修正胶。浓硝酸氧化雌黄可制得硫黄,并生成砷酸和一种红棕色气体,利用此反应原理设计为某原电池。下列有关叙述正确的是
A. 砷酸的分子式为H2AsO4
B. 红棕色气体在该原电池的负极区生成并逸出
C. 该反应的氧化剂和还原剂物质的量之比为12:1
D. 该反应中每析出4.8g硫黄,则转移0.5mol电子
难度: 中等查看答案及解析
-
中国文化源远流长,下列对描述内容所做的相关分析不正确的是
选项
描述
分析
A
《本草纲目》中“采蒿蓼之属,晒干烧灰,以水淋汁,……洗衣发面,亦去垢发面。”
所描述之物为K2CO3
B
《新修本草》对“靑矾”的描述:“本来绿
色,…….正如瑠璃……烧之赤色……”
文中涉及的操作方法
指干馏
C
“司南之杓(勺),投之于地,其柢(勺柄)指南”
司南中“杓”的材质为Fe3O4
D
“用浓酒和糟入甑,蒸令气上,用器承滴露”
其中涉及的操作是蒸馏
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
针对下列实验现象表述不正确的是
A. 用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色
B. 在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色
C. 向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D. 将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成
难度: 困难查看答案及解析
-
如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是 ( )
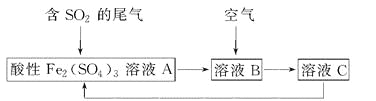
A.溶液B中发生的反应为2SO2+O2=2SO3
B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:Fe3+>O2>SO42—
D.此工艺的优点之一是物质能循环利用
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法不正确的是( )
A.Zn与某浓度HNO3溶液反应,生成的还原产物为N2O与NH4NO3,共1 mol,则反应过程中转移电子总数为8 NA
B.120 g NaHSO4和KHSO3的固体混合物中含有的阳离子数为NA
C.标准状况下,2.24 L甲烷与7.1 g氯气在光照条件下反应得到CH3Cl的分子数小于0.1 NA
D.1 mol FeCl2在酸性条件下与足量双氧水充分反应,整个过程转移电子数目为NA
难度: 中等查看答案及解析
-
化合物Y具有抗菌、消炎作用,可由X制得。
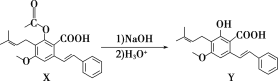
下列有关化合物X、Y的说法正确的是( )
A.1 mol X最多能与2 mol NaOH反应
B.Y与乙醇发生酯化反应可得到X
C.X、Y均能与酸性KMnO4溶液反应
D.室温下X、Y分别与足量Br2加成的产物分子中手性碳原子数目不相等
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层有2个电子,Z的单质晶体是应用最广泛的半导体材料,W与X位于同一主族。下列说法正确的是
A.原子半径:r(W)> r(Z)> r(Y)> r(X)
B.由X、Y组成的化合物是离子化合物
C.Z的最高价氧化物对应水化物的酸性比W的强
D.W的简单气态氢化物的热稳定性比X的强
难度: 简单查看答案及解析
-
某学习小组的同学根据“侯氏制碱法”的原理:
①NH3+H2O+CO2+NaCl===NaHCO3↓+NH4Cl
②2NaHCO3
Na2CO3+H2O+CO2↑
利用如下实验装置制备Na2CO3。
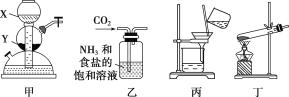
下列叙述正确的是( )
A.若X为稀硫酸,Y为碳酸钙,则可用装置甲制取CO2
B.装置乙中会有白色沉淀析出
C.将装置丙中所得滤液蒸干可得到NH4Cl固体
D.用装置丁加热NaHCO3固体可制得Na2CO3
难度: 中等查看答案及解析
-
某种 “全氢电池”的工作原理如图所示。下列说法错误的是( )
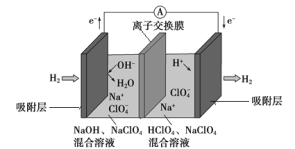
A.右边吸附层中发生了氧化反应
B.负极的电极反应是H2-2e-+2OH-===2H2O
C.该电池总反应是H++OH-===H2O
D.电解质溶液中Na+向右移动、ClO4-向左移动
难度: 中等查看答案及解析
-
常温下,向10mL0.1mol·L-1CuCl2溶液中滴入0.1ml·L-1的Na2S溶液,滴加过程中溶液中-1gc(Cu2+)随滴人的Na2S溶液体积的变化如图所示。下列叙述正确的是
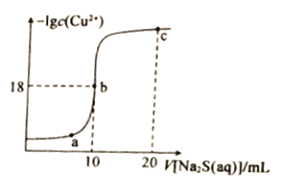
A.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)==2c(Na+)
B.Ksp(CuS)的数量级为10-36
C.a、b、c三点溶液中,b点水的电离程度最大
D.c点溶液中:c(C1-)=2c(Na+)
难度: 中等查看答案及解析
-
25 ℃时,向等浓度的NaCl和Na2CrO4溶液中分别滴加AgNO3溶液(已知:Ag2CrO4为砖红色),平衡时溶液中相关离子浓度的关系如图所示。下列说法正确的是( )
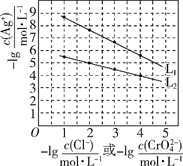
A.L1为向Na2CrO4溶液中滴加AgNO3溶液时的离子浓度关系曲线
B.Ksp(AgCl)的数量级为10-12
C.L1和L2交点处对应的两种溶液中c(Ag+)=c(Cl-)=c(CrO42-)
D.用AgNO3标准溶液测定溶液中Cl-含量时可用Na2CrO4做指示剂
难度: 中等查看答案及解析
-
实验室分别用图1、图2装置完成石蜡油分解实验和煤的干馏实验。下列说法不正确的是( )
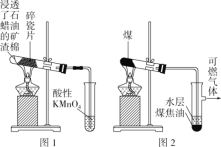
A.图1中碎瓷片为反应的催化剂
B.图1中酸性KMnO4溶液褪色可证明有乙烯生成
C.图2中得到的煤焦油含有苯、甲苯等有机物
D.取图2中水层,滴加酚酞溶液,溶液变红
难度: 中等查看答案及解析
-
H2C2O4是一种二元弱酸。常温下向H2C2O4溶液中滴加NaOH溶液,混合液中lgX随pH的变化关系如图所示。下列说法不正确的是( )
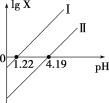
A.线Ⅰ中X表示的是
B.线Ⅰ、Ⅱ的斜率均为1
C.c(HC2O42-) > c(C2O42-) > c(H2C2O4)对应溶液pH:1.22 < pH < 4.19
D.c(Na+)=c(HC2O4-)+2c(C2O42-)对应溶液的pH=7
难度: 困难查看答案及解析
-
室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )
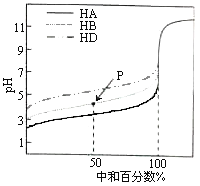
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
难度: 中等查看答案及解析

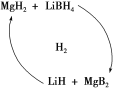
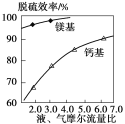
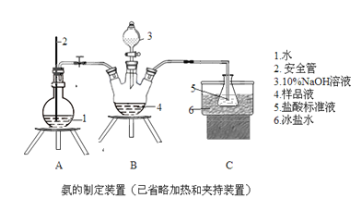
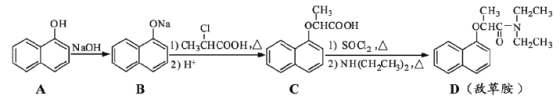
 ,若以苯酚和乙酸为原料制备
,若以苯酚和乙酸为原料制备