-
小明同学归纳总结了初中所学稀硫酸的化学性质,并用“H2SO4+X→盐+Y”这种表达式进行整理。下列小明的观点错误的是( )
选项
X的物质类别
观点描述
A
金属
若X为Cu,则反应能够发生
B
金属氧化物
若X为MgO,则Y为H2O
C
碱
若X为NaOH,则盐为Na2SO4
D
盐
若X为BaCl2,则生成白色沉淀
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列化学用语表示正确的是
A.五氧化二磷的化学式:P2O5 B.硅的元素符号:SI
C.碳酸根离子:CO3 D.三个氧原子:O3
难度: 简单查看答案及解析
-
化学与生产、生活密切相关。下列说法错误的是
A.干冰可作制冷剂,广泛用于食品冷藏保鲜
B.N2、NO、NO2等含氮物质均为空气污染物
C.明矾溶于水的胶状物可吸附杂质,达到净水的目的
D.废旧电池的分类回收有利于保护环境
难度: 简单查看答案及解析
-
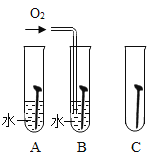
规范的实验操作是安全地进行实验并获得成功的保证。下列实验操作正确的是
A.
 振荡试管充分反应 B.
振荡试管充分反应 B.溶解NaCl固体
C.
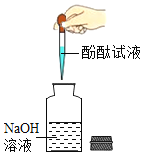 检验溶液的酸碱性 D.
检验溶液的酸碱性 D.检查装置的气密性
难度: 简单查看答案及解析
-
下列说法中正确的是
A.检验电解水的产物,可判断水的组成元素 B.将pH试纸用水湿润后,测定柠檬汁的pH
C.凡是无色的、均一的液体一定是溶液 D.硫在O2中燃烧发出淡蓝色火焰,生成SO3
难度: 简单查看答案及解析
-
碘是人体必需的微量元素之一,有“智力元素”之称。下图为碘在元素周期表中的相关信息及原子结构示意图,据此判断下列说法正确的是
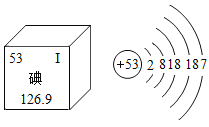
A. 碘是一种金属元素 B. 碘原子的核外有7个电子层
C. 碘原子的核电荷数为53 D. 碘的相对原子质量为126.9g
难度: 中等查看答案及解析
-
丙氨酸是一种常见的氨基酸,其化学式为C3HxO2N,相对分子质量是89.下列说法正确的是
A.丙氨酸属于无机化合物 B.丙氨酸中碳、氮元素的质量比为3:1
C.丙氨酸化学式中x=7 D.每个丙氨酸分子中含有一个氧气分子
难度: 中等查看答案及解析
-
“催化转化器”可将汽车尾气中的有毒气体处理为无污染的气体,下图为该反应的微观示意图。
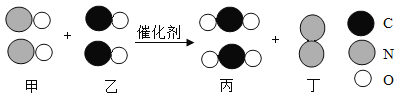
下列说法正确的是
A.该反应中四种物质均为化合物 B.该反应前后原子数目发生改变
C.甲、丁中同种元素化合价相同 D.乙、丙中所含元素种类相同
难度: 中等查看答案及解析
-
为了达到相应的实验目的,下列实验设计不合理的是
A.
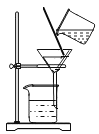 分离H2O2和MnO2制O2后的固液混合物
分离H2O2和MnO2制O2后的固液混合物B.
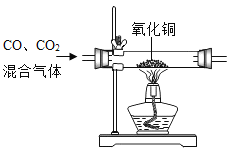 除去CO中的CO2气体
除去CO中的CO2气体C.
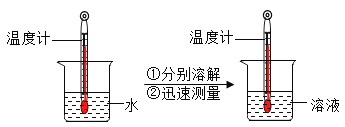 区分NaCl、NH4NO3、NaOH三种固体
区分NaCl、NH4NO3、NaOH三种固体D.
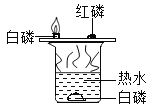 探究可燃物燃烧的条件
探究可燃物燃烧的条件难度: 中等查看答案及解析
-
下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线。下列说法正确的是

A.甲的溶解度大于乙的溶解度
B.a1℃时,甲、乙饱和溶液的温度升温至a2℃时,均有固体析出
C.a2℃时,M点对应的甲溶液不饱和
D.a2℃时,乙饱和溶液的质量分数为20%
难度: 中等查看答案及解析