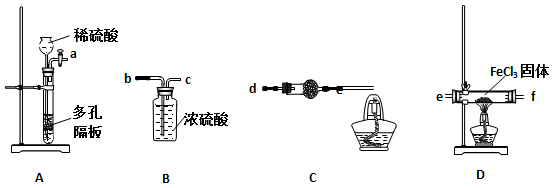
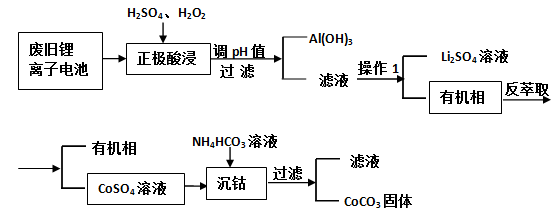
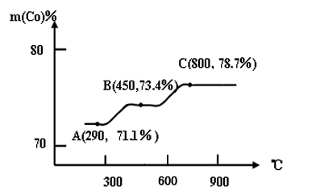
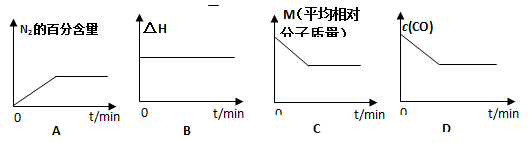
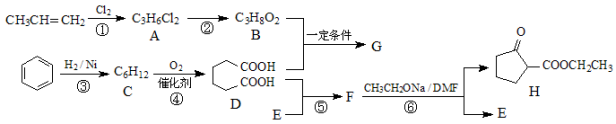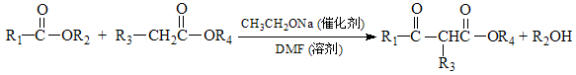-
化学与生产、生活、社会密切相关。下列说法中正确的是( )
A.漂白粉长期放置会被空气中的氧气氧化而变质
B.不锈钢具有较强的耐腐蚀性,纯铁也有较强的耐腐蚀性
C.汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素而产生的
D.对石油进行分馏可以得到许多苯的同系物
难度: 中等查看答案及解析
-
二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构。下列说法中不正确的是 ( )
A.它能发生还原反应
B.它能燃烧
C.它的一溴取代物只有一种
D.此分子中共平面的原子最多有18个
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8NA
B.标准状况下,11.2 L 二氯甲烷中含有的分子数目为0.5NA
C.常温常压下,28 g乙烯与丙烯的混合气体含有的碳原子数目无法计算
D.0.1 mol·L-1MgCl2溶液中含有的Mg2+数目小于0.1NA
难度: 困难查看答案及解析
-
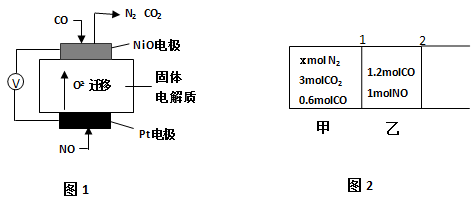
如图甲是一种利用微生物将废水中的尿素(H2NCONH2,氮元素显-3价)的化学能直接转化为电能,并生成对环境无害物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中不正确的是( )
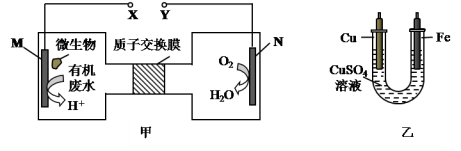
A.H十透过质子交换膜由左向右移动
B.铜电极应与Y相连接
C.M电极反应式: H2NCONH2+H2O-6e-
CO2↑+N2↑+6H+
D.当N电极消耗0.25 mol气体时,则铁电极增重16g
难度: 困难查看答案及解析
-
X、Y、Z、W属于短周期主族元素。X元素的原子半径最大,Y元素的最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子核外电子数之比为2:1。下列说法中错误的是( )
A.X与Y形成的两种化合物中阴阳离子个数比为1:2
B.Y分别与Z、W、R以两种元素组成的常见化合物有5种
C.Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物熔沸点低
D.Z、W、R的最高价氧化物对应水化物的酸性强弱顺序是R>W>Z
难度: 困难查看答案及解析
-
下列实验操作、现象与结论对应关系正确的是( )
选项
实验操作
实验现象
结论
A
向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液
试管口出现红棕色气体
溶液中NO3—被Fe2+还原为NO2
B
向含有酚酞的Na2CO3溶液中加入少量BaC12固体,
溶液红色变浅
证明Na2CO3溶液中存在水解平衡
C
等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体
HX放出的氢气多且反应速率快
HX酸性比HY强
D
分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH
后者较大
证明非金属性
S>C
难度: 困难查看答案及解析
-
室温下,0.2 mol·L-1的一元碱BOH与等浓度的盐酸等体积混合后,所得溶液中部分微粒的组分及浓度如图所示,下列对混合溶液的分析正确的是 ( )
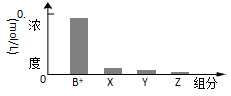
A.溶液可能显中性或酸性
B.升温,c(X)增大,c(Y)减小
C.c(B+) + c(Y) = c(Cl-)
D.稀释溶液,c(X)增大,c(Z)增大
难度: 中等查看答案及解析