-
下列物质能使品红溶液褪色,其中是利用强氧化性来漂白的是
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫 ⑤臭氧
A. ①③④ B. ②③⑤ C. ①②③④ D. ①③④⑤
难度: 中等查看答案及解析
-
在自然界中,既有以游离态形式存在,又有以化合态形式存在的元素是( )
A.硫 B.硅 C.氯 D.铝
难度: 中等查看答案及解析
-
下图中能实现人工固氮的是
A.
 闪电 B.
闪电 B. 合成氨车间 C.
合成氨车间 C.豆科植物根瘤 D.
 绿色植物光合作用
绿色植物光合作用难度: 简单查看答案及解析
-
要“持续实施大气污染防治行动,打赢蓝天保卫战。”下列措施不利于“打赢蓝天保卫战”的是
A.推广燃煤脱硫技术,防治SO2污染 B.推广使用共享单车,倡导绿色出行
C.研制电动汽车,逐步取代燃油汽车 D.加快石油开采速度,加大化石能源供应
难度: 简单查看答案及解析
-
下列有关实验的“先”与“后”的操作正确的是
A.蒸馏实验结束后,先停止通冷凝水,后停止加热
B.分液操作时,先从下口放出下层液体,后放出上层液体
C.配制一定物质的量浓度溶液时,容量瓶必须先干燥后使用
D.焰色反应时,铂丝先用稀盐酸洗涤,后放在酒精灯火焰上灼烧
难度: 简单查看答案及解析
-
下列物质露置在空气中,质量会减轻的是
A.NaOH固体 B.Na2SO3固体 C.浓HNO3 D.浓H2SO4
难度: 简单查看答案及解析
-
下列变化过程需要加入氧化剂才能实现的是
A.MnO4-→Mn2+ B.SiO2→Na2SiO3 C.SO2→SO42- D.NO2→N2O4
难度: 简单查看答案及解析
-
下列物质的水溶液,其中一种能分别与其他三种发生离子反应,这种物质是
A.H2SO4 B.NaOH C.BaC12 D.K2CO3
难度: 简单查看答案及解析
-
下列所给物质的性质和用途具有对应关系的是
A.一氧化碳具有还原性——冶炼金属
B.碳酸氢铵受热易分解——化肥
C.氯气能溶于水——自来水消毒
D.二氧化硫具有还原性——漂白剂
难度: 简单查看答案及解析
-
向硫酸亚铁溶液中投入一小块金属钠,反应后滤出沉淀并洗涤,然后在氧气中灼烧沉淀,得到的固体物质是
A.Fe B.Fe3O4 C.Fe(OH)3 D.Fe2O3
难度: 中等查看答案及解析
-
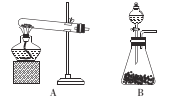
实验室能用如图所示的装置干燥、收集的气体是

A.NH3 B.Cl2 C.SO2 D.NO2
难度: 中等查看答案及解析
-
以下化学反应的产物种类与反应物的浓度、用量和反应条件均无关的是
A.Al与硫酸反应 B.Na与O2反应
C.CO2通入NaOH溶液中 D.NH3通入AlCl3溶液中
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的数值,下列叙述中正确的是
A.常温常压下,11.2 LNH3所含的原子数为2NA
B.标准状况下,22.4 LCl2所含的原子数为NA
C.常温常压下,80 gSO3所含的氧原子数为3NA
D.一定条件下,56 g铁与足量HNO3完全反应,转移电子数为2NA
难度: 中等查看答案及解析
-
将19.5 g锌粉加入100 mL2 mol.L-l RO2+溶液中,恰好完全反应,则还原产物可能是
A.R B.R2+ C.R3+ D.RO2+
难度: 中等查看答案及解析
-
下列有关实验的叙述中,正确的是
①仅用蒸馏水就可鉴别食盐、硫酸铜粉末、碳酸钙粉末
②用分液漏斗分离乙醇和水的混合物
③稀释浓硫酸时,将浓硫酸沿烧杯壁慢慢注入水中并不断搅拌
④用玻璃棒蘸取溶液滴在pH试纸中央,测该溶液的pH
⑤配制一定物质的量浓度的溶液,需要的玻璃仪器只有容量瓶和烧杯
A.①④⑤ B.①③④ C.①②⑤ D.③④⑤
难度: 中等查看答案及解析
-
下列有关物质制备的说法错误的是
A.用铜与浓硝酸反应制备少量的二氧化氮
B.室温下用金属钠与氧气反应制取过氧化钠
C.工业上将过量氯气通入石灰乳中制取漂白粉
D.二氧化硫与稍过量的氨水反应制备亚硫酸铵
难度: 中等查看答案及解析
-
已知甲、乙、丙、丁是中学化学中四种常见的物质,其转化关系如图所示。则甲和丁可能是
①N2和O2 ②C12和Fe ③C和O2 ④SO2和NaOH溶液
A.①② B.①②③ C.②③④ D.①②③④
难度: 中等查看答案及解析
-
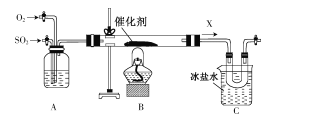
将SO2通入BaCl2溶液至饱和的过程中,始终未观察到溶液中出现白色沉淀,若再通入另一种气体X,有白色沉淀产生。则气体X不可能是
A.NH3 B.NO2 C.Cl2 D.CO2
难度: 困难查看答案及解析
-
某溶液中只含有四种离子,已知其中三种离子K+、Ba2+、Cl-的物质的量浓度分别是2 mol/L 、1 mol/L 、1 mol/L ,则溶液中另一离子及其物质的量浓度不可能为
A.SO42- ,1.5 mol/L B.HCO3-,3mol/L C.OH-,3 mol/L D.NO3-,3mol/L
难度: 中等查看答案及解析
-
下列陈述I、Ⅱ均正确且有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
Cl2有漂白作用
Cl2能使湿润的有色布条褪色
B
浓硫酸有强氧化性
浓硫酸可以与铜反应生成H2
C
液氨汽化时要吸收大量的热量
液氨可以做制冷剂
D
SiO2有导电性
SiO2可用于制光导纤维
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
25.4g某二价金属的氯化物RCl2 中含有0.4mol的Cl-,则R的元素符号为
A.Mg B.Ca C.Fe D.Cu
难度: 简单查看答案及解析
-
同温同压下,在3支相同体积的试管中分别充有等体积的下列气体:①NO2,②HC1,③NH3。现将3支试管均倒置于水槽中,充分溶解后,所得溶液的物质的量浓度大小关系正确的是
A.①>②>③ B.①=②=③ C.②=③>① D.③>②>①
难度: 困难查看答案及解析
-
下列离子的检验方法和结论均正确的是
A.加入BaCl2溶液,有不溶于稀硝酸的白色沉淀生成,证明原溶液中一定含有Ag+
B.先加入新制氯水,再滴加KSCN溶液,溶液变红,证明原溶液中一定含有Fe2+
C.加入NaOH溶液,微热,产生的气体能使湿润的红色石蕊试纸变蓝,证明原溶液一定有NH4+
D.加入足量稀盐酸,产生的无色无味气体能使澄清石灰水变浑浊,证明原溶液中一定有CO32-
难度: 中等查看答案及解析
-
表示下列反应的离子方程式正确的是
A.金属钠加入CuSO4溶液中:
B.金属铝加入NaOH溶液中:
C.铁粉加入FeC13溶液中:
D.铜片插入浓HNO3溶液中:
难度: 中等查看答案及解析
-
下列实验操作不能达到实验目的的是
选项
实验目的
实验操作及现象
A
证明钠与水的反应放热
将钠投入水中,剧烈反应,钠熔化成闪亮的小球,四处游动
B
证明敞口放置的亚硫酸钠溶液已部分变质
向试样中滴加BaCl2溶液,有白色沉淀生成
C
证明氧化铝的熔点高于铝的熔点
将砂纸打磨过的铝箔放在酒精灯上灼烧,铝箔熔化而不滴落
D
证明蛋白质溶液属于胶体
用激光照射蛋白质溶液,侧面能看到光亮的通路
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某学习小组用如图所示的装置及药品进行酸性强弱比较的实验。下列说法正确的是

A.①和②中发生的反应均为置换反应
B.其他条件不变,可用盐酸替代稀硫酸
C.一段时间后,②中有胶冻状物质生成
D.该实验证明酸性:硫酸>硅酸>碳酸
难度: 中等查看答案及解析
-
一定质量的铜与浓硝酸恰好完全反应,生成NO2、N2O4、NO的混合气体,这些气体与2.24 LO2(标准状况下)混合后通入水中,所有气体被水完全吸收生成硝酸。则参加反应的铜的质量为
A.3.2 g B.6.4 g C.12.8 g D.条件不足,无法计算
难度: 困难查看答案及解析
-
叠氮化钠(NaN3)与硝酸钾碰撞时发生的反应为:
。若有1 mol N2生成,则下列判断正确的是
A.生成N2的体积一定为22.4 L B.有0. 125 mol KNO3被氧化
C.Na2O为氧化产物,N2为还原产物 D.转移电子的物质的量为0.625 mol
难度: 中等查看答案及解析
-
向10 mLFe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中剩余固体的质量与加入铁粉的质量如图所示。下列说法错误的是

A.a点时溶液中金属阳离子有Fe3+、Cu2+和Fe2+
B.b点时溶液中的离子反应有两种
C.原溶液中n(Fe3+):n(Cu2+)=1:1
D.原溶液中Fe2(SO4)3的物质的量浓度为1 mol/L
难度: 中等查看答案及解析