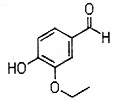
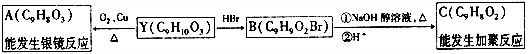-
下列叙述中,不正确的是( )
A.天然药物无毒副作用,适合任何人群服用
B.置换反应都属于氧化还原反应
C.氡()原子核中含有136个中子
D.AgI胶体的分散质粒子直径在1nm~100nm之间难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.聚氯乙烯塑料能用于包装熟食
B.乙酸乙酯与CH3CH2COOH互为同分异构体
C.乙醇和乙酸发生酯化反应不属于取代反应
D.淀粉是人类重要的营养物质,在人体内可以水解成葡萄糖难度: 中等查看答案及解析
-
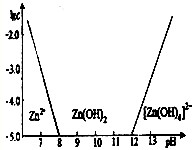
下列叙述正确的是( )
A.可以把氯化钠归类为钠盐、离子化合物、非电解质
B.常温下=0.1mol•L-1的溶液中,Na+、K+、SiO32-、NO3-一定能大量共存
C.氢氧化铁加到氢碘酸中,反应为Fe(OH)3+3HI=FeI3+3H2O
D.FeO、Fe、CuO、C四种黑色固体不可能只用一种试剂来鉴别难度: 中等查看答案及解析
-
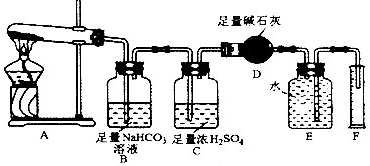
下列叙述正确的是( )

A.欲配制质量分数为10%的CuSO4溶液,可将10g CuSO4-5H2O溶解在90g蒸馏水中
B.中和滴定时,滴定前滴定管必须洗净并烘干
C.可用如图装置干燥、储存、吸收多余HCl气体
D.给试管中的液体加热时,可加入碎瓷片防止暴沸难度: 中等查看答案及解析
-
NA表示阿佛伽德罗常数,下列说法正确的是( )
A.200mL0.1mol•L-1Fe2(SO4)3溶液中,含Fe 3+和SO42-离子总数为0.1NA
B.0.1molFe与0.1molCl2充分反应,转移的电子数为0.3NA
C.2.24L的氮气和氧气混合气体中,含原子总数为0.2NA
D.6.4g的S2和S8混合物中,含硫原子总数为0.2NA难度: 中等查看答案及解析
-
25时,部分弱酸的电离平衡常数如下表:
下列有关说法正确的是( )弱酸 CH3COOH HCN H2CO3 电离平衡常数 1.8×10-5 4.9×10-10 K1=4.3×10-7 K2=5.6×10-11
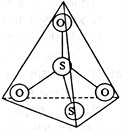
A.等物质的量浓度溶液的pH关系为pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol•L-1HCN溶液与b mol•L-1NaOH溶液等体积混合后,所得溶液中:C(Na+)>c(CN-),则a一定小于b
C.往冰醋酸中逐滴加水,溶液的导电性先增大后减小
D.NaHCO3和Na2CO3的混合液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)难度: 中等查看答案及解析
-
镁--H2O2酸性电池采用海水(加入一定量酸)作电解质,下列说法正确的是( )
A.电池总反应为Mg+H2O2+2H+=Mg2++2H2O
B.负极反应为H2O2+2e-+2H+=2H2O
C.电池工作时,正极周围海水的pH减小
D.电池工作时,溶液中的H+向负极移动难度: 中等查看答案及解析