-
某无色酸性溶液中,一定能够大量共存的离子组是
A. Fe2+、Ba2+、NO3-、Cl- B. Na+、NH4+、SO42-、Cl-
C. Na+、K+、HCO3-、NO3- D. Na+、K+、MnO4-、Br-
难度: 中等查看答案及解析
-
甲、乙、丙、丁分别是Al2(SO4)3、FeCl2、NaOH、BaCl2四种物质中的一种。若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生。据此可推断丙物质是( )
A.Al2(SO4)3 B.NaOH C.BaCl2 D.FeCl2
难度: 中等查看答案及解析
-
下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
A.NaHSO4和Ba(OH)2
B.AlCl3和NaOH
C.NaAlO2和H2SO4
D.Na2CO3和H2SO4
难度: 困难查看答案及解析
-
对于反应:KClO3 + 6HCl → KCl +3Cl2↑ + 3H2O,若有0.1molKClO3参加反应,下列说法正确的是
A.被氧化的HCl为0.6mol
B.转移电子1.806×1023个
C.产生气体为6.72L
D.还原剂占参加反应HCl的5/6
难度: 困难查看答案及解析
-
下列我国古代的技术应用中,其工作原理不涉及化学反应的是粮食的主要成份是淀粉,而经过反应, 生成了新的物质酒(主要成分乙醇),所以这一过程不是化学变化的是( )
A.湿法炼铜 B.粮食酿酒 C.火药使用 D.沙里淘金
难度: 简单查看答案及解析
-
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列说法正确的是( )
A.它在水中所形成的分散系为乳浊液。
B.它的分子既能透过滤纸,也能透过半透膜
C.它在水中形成的分散系与雾的分散系相同
D.它的分子直径比Na+小,溶于水后有丁达尔现象
难度: 简单查看答案及解析
-
化学与生活密切相关,下列说法错误的是( )
A.用粘土焙烧制的红陶,陶器显红色的原因可能是含有
B.氢氧化铝、小苏打可作胃酸的中和剂
C.烟花中添加了含铁、铂元素的化合物会更加绚丽缤纷
D.水玻璃暴露在空气中会发生变质
难度: 简单查看答案及解析
-
已知NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.7.8 g过氧化钠与足量水反应转移的电子数为0.2NA
B.标准状况下,22.4 L H2O含有NA个水分子
C.2 g H2的分子数为NA
D.1 mol/L Mg(NO3)2溶液中含有NO3—的数目为2NA
难度: 困难查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.
与水反应:
+
=
B.铁与稀硫酸反应:2Fe+6
=2
+3
↑
C.
溶液和
溶液反应:
↓
D.CaCO3和稀硝酸反应:CaCO3+
=Ca2++
↑+
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.同温、同压下,相同质量的气体都占有相同的体积
B.同温、同压下,相同体积的气体都含有相同数目的分子
C.同温、同压下,CH4与O2的密度之比1:2
D.由0.2gH2和8.8gCO2、5.6gCO组成混合气体,在标准状况下的体积约为11.2L
难度: 中等查看答案及解析
-
在下列反应中,水既不是氧化剂又不是还原剂的是( )
A.C+H2O═CO+H2
B.2Na2O2+2H2O═2NaOH+O2↑
C.2Na+2H2O═2NaOH+H2↑
D.2F2+2H2O═4HF+O2
难度: 简单查看答案及解析
-
下列能达到实验目的的是( )
A.用碳酸钠溶液除去二氧化碳中混有的氯化氢气体
B.用氢氧化钠除去氯气中混有的少量氯化氢气体
C.用氢氧化钠溶液除去铁粉中混有的少量铝粉
D.配制一定浓度的氯化钾溶液1000mL,准确称取氯化钾固体,放入到1000mL容量瓶中,加热溶解,振荡摇匀,定容
难度: 中等查看答案及解析
-
以下物质之间的每步转化中,都能通过一步实现的是( )
①Fe→FeCl2→Fe(OH)2→Fe(OH)3
②Na→Na2O→Na2CO3→NaHCO3→CaCO3
③Mg→MgCl2→Mg(OH)2
④Al→Al2O3→Al(OH)3
⑤Al→NaAlO2→Na2CO3
A.②③④ B.①③④⑤ C.①②③⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A.含金属元素的离子一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
难度: 简单查看答案及解析
-
用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是.( )
A.④③⑦⑤⑥; B.②⑤⑦⑥; C.①③⑤⑥⑦; D.②⑥③⑦⑤⑥
难度: 简单查看答案及解析
-
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与加入NaOH溶液的体积关系图如图所示,则混合溶液中Al2(SO4)3和MgSO4的物质的量之比为( )
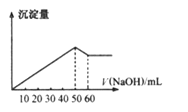
A.6:1 B.3:1 C.2:1 D.1:2
难度: 中等查看答案及解析
-
下列反应最终没有固体析出的是
A. 向氯化钡溶液中通入少量CO2
B. 向饱和氢氧化钠溶液中加入钠单质
C. 向饱和碳酸钠溶液中通入过量CO2
D. 向NaHCO3溶液中加入过量澄清石灰水
难度: 困难查看答案及解析
-
2019年诺贝尔化学奖颁给几位在锂离子电池研发领域做出贡献的科学家,锂单质化学性质与钠类似,活泼性比钠略弱。它的密度为0.534g/cm3,锂元素的焰色为紫红色,将绿豆大的锂投入水中,下列实验现象合理的有( )
①锂沉入水中
②锂浮在水面上
③水中有大量气泡
④反应后在水中加入几滴石蕊试液,溶液变红
⑤反应剧烈,发出紫红色火焰
⑥锂四处游动
A.②③ B.①③ C.②③⑤ D.②④⑤⑥
难度: 简单查看答案及解析
-
将Fe,Cu的混合物投入含有Fe2+,Cu2+,Fe3+的溶液中,反应后有铁剩余,则容器内还应存在的微粒是( )
A.Fe3+,Fe2+ B.Fe2+,Cu2+ C.Cu,Fe2+ D.Cu,Cu2+
难度: 简单查看答案及解析
-
已知下列转化关系图,且知采用电解熔融氯化钠的方法可以生产金属钠:2NaCl(熔融)
2Na+Cl2↑,下列说法不正确的是( )
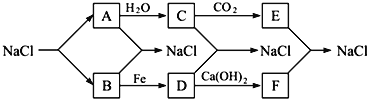
A.A、C、E一定含有同种元素 B.若在B中点燃铜丝会产生棕黄色烟
C.C与D反应会产生红褐色沉淀 D.D物质可能为FeCl2
难度: 简单查看答案及解析