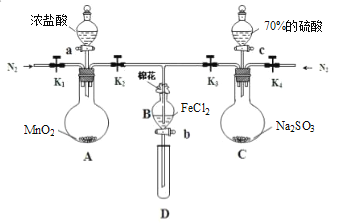
-
NA代表阿伏加德罗常数,下列说法正确的是
A. NA个SO3分子在标准状况下的体积为22.4L
B. 2g氢气所含原子数为NA
C. 在一定条件下,1mol N2和3mol H2充分反应转移的电子数为6NA
D. 18gH2O所含质子数为10NA
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A. 向Na2CO3 溶液中加入过量CH3COOH溶液:CO32- + 2H+ = CO2↑+H2O
B. 少量CO2 通入Ca(ClO)2 溶液中:ClO- + CO2+ H2O = HCO3- + HClO
C. 钠与水反应: 2Na + 2H2O=2Na+ + 2OH- + H2↑
D. 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+ H2O
难度: 简单查看答案及解析
-
下列说法正确的是
A. 用氨水可以鉴别MgCl2溶液和AlCl3溶液 B. 可以用澄清的石灰水鉴别SO2和CO2
C. SO2能使KMnO4溶液、溴水溶液褪色 D. 金属钠与CuSO4溶液反应能析出单质Cu
难度: 中等查看答案及解析
-
下列关于有机物的说法中,错误的是( )
A. 乙烯常温下是气体,聚乙烯常温下是固体
B. 甲烷和乙烷在光照的条件下都能发生取代反应
C. 乙烷和乙烯在一定条件下都能发生加成反应
D. 苯可做有机溶剂
难度: 中等查看答案及解析
-
对于300mL1mol/L盐酸与铁片的反应,采取下列措施:
①升高温度 ②改用100mL 3mol/L盐酸
③再加300mL 1mol/L盐酸 ④用等量铁粉代替铁片
⑤改用100mL 98%的硫酸 其中能使反应速率加快的是
A.①②④ B.①③④ C.①②③④ D.①②③⑤
难度: 简单查看答案及解析
-
判断下列说法,其中正确的组合是( )
①煤、石油、天然气是当今世界重要的化石能源
②电力、风力、生物质能均是一次能源
③化学变化中的能量变化主要是由化学键的变化引起的
④吸热反应发生时一定要加热,放热反应发生时不需要加热
⑤等质量的糖类在体内发生氧化还原反应和在体外燃烧均生成CO2和水时,放出的能量不可能相等
⑥充电电池可以无限制地反复放电、充电
⑦充电时的电池反应和放电时的电池反应为可逆反应
⑧石油裂化、裂解为化学变化,而煤的气化和石油的分馏均为物理变化
A.①②⑤⑦
B.②③④⑥
C.①③
D.①③④⑧
难度: 简单查看答案及解析
-
下列化学用语书写正确的是
A. 氯原子的结构示意图:
B. 作为相对原子质量测定标准的碳核素:
C
C. 氯化镁的电子式:
D. 用电子式表示氯化氢分子的形成过程:
难度: 简单查看答案及解析
-
下列有关比较正确的是( )
A.N、O、F最高价依次升高
B.Al3+、S2-、F- 微粒半径依次增大
C.单质的熔点:Cl2>Br2>I2
D.碱性:CsOH>KOH>NaOH
难度: 简单查看答案及解析
-
关于下列粒子的描述不正确的是( )
A.PH3的电子式为
,其热稳性不如NH3
B.HS-的电子式为
,是含有极性键的18电子的粒子
C.CH2Cl2的电子式为
,是分子结构呈四面体的分子
D.KF的电子式为K+
,它是易溶于水的离子化合物
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.NaHSO4在熔融状态下电离与在水中电离时,破坏的化学键完全相同
B.H2O比H2S分子稳定,是因为H2O分子间能形成氢键
C.NaCl和HCl气化时,克服的作用力不相同,故沸点不同
D.碘沸点低、易升华,是因为分子中的 I﹣I键能较小
难度: 中等查看答案及解析
-
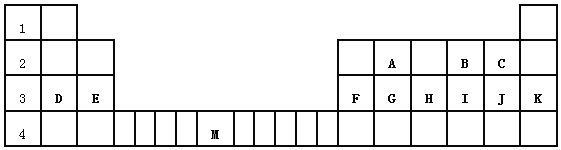
如图是部分短周期元素原子半径与原子序数的关系图,下列说法正确的是( )

A.M的最高价氧化物对应水化物能分别与Z、R的最高价氧化物对应水化物反应
B.可用还原剂还原R的简单离子制备R单质
C.X、N两种元素组成的化合物熔点很低
D.简单离子的半径:Z<X<Y
难度: 简单查看答案及解析
-
现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且每个甲、乙、丙分子中均含10个电子,Y和Z化合生成丁,有关物质的转化关系如下图所示。下列说法正确的是( )

A. 原子半径由小到大的顺序是:W<Z<Y<X
B. Z的最高价氧化物对应的水化物一定为强酸
C. 化合物的沸点由高到低的顺序是:乙>甲>丙
D. Y与W、Z都只能形成两种化合物
难度: 中等查看答案及解析
-
下列化学反应符合图示的是
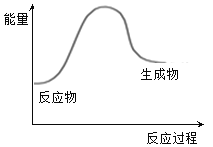
①冰雪融化 ②KMnO4分解制O2③铝与氧化铁的反应④钠与水反应⑤二氧化碳与灼热的木炭反应⑥碘的升华 ⑦Ba(OH)2·8H2O和NH4Cl的反应
A.
B.
C.
D.
难度: 简单查看答案及解析
-
已知4NH3+5O2═4NO+6H2O,反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正确的是( )
A.4/5v(O2)= v(NO)
B.5/6v(O2)= v(H2O)
C.2/3v(NH3)= v(H2O)
D.4/5v(NH3)= v(O2)
难度: 简单查看答案及解析
-
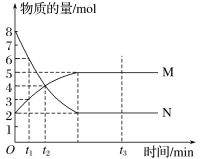
某温度下,在一固定容积的密闭容器中进行反应:A2 +B2
2AB。该条件下,A2、B2、AB均为气体。下列情况一定能说明该反应已达到化学平衡状态的是( )
A. 气体的密度不再改变时
B. 气体的总物质的量不再改变时
C. 混合气体中各组分的含量不再改变时
D. 每消耗1molB2同时有2molAB生成时
难度: 中等查看答案及解析
-
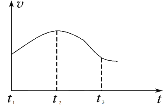
把在空气中久置的铝片5.0g投入盛有50mL 0.1mol•L-1盐酸溶液的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系,可用如图所示的坐标曲线来表示,下列推论错误的是( )
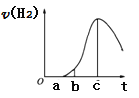
A.O→a段不产生氢气是因为表面的氧化物隔离了铝和稀盐酸
B.a→b段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时刻,反应处于平衡状态
D.t>c,产生氢气的速率降低的主要原因是溶液中H+浓度下降
难度: 中等查看答案及解析
-
下列装置中能形成原电池的是( )
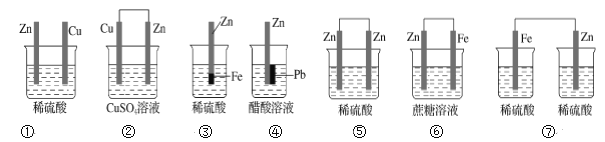
A. ①③⑤ B. ②④⑥ C. ①⑤⑥ D. ②③④
难度: 中等查看答案及解析
-
有一种瓦斯分析仪(下图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的的是( )
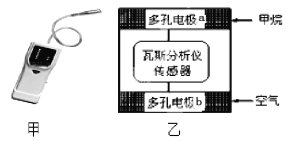
A. 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B. 电极a的反应式为:CH4+5O2-―8e-=CO32- +2H2O
C. 电极b是正极, O2-由电极a流向电极b
D. 当固体电解质中有1 mol O2-通过时,电子转移4 mol
难度: 简单查看答案及解析
-
有A、B两种烃,含碳的质量分数相同,关于A,B的叙述中正确的是
A.A和B一定是同分异构体
B.A和B不可能是同系物
C.A和B的最简式一定相同
D.A和B各1mol完全燃烧后生成CO2的质量一定相同
难度: 简单查看答案及解析
-
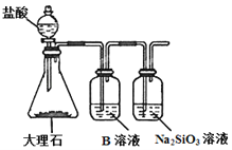
在实验室中,下列除杂的方法中正确的是( )
A.溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出溴
B.乙烷中混有乙烯,通入H2在一定条件下反应,使乙烯转化为乙烷
C.硝基苯中混有浓硫酸和浓硝酸,将其倒入NaOH溶液中,静置、分液
D.乙烯中混有CO2和SO2,将其通入酸性KMnO4溶液中洗气
难度: 简单查看答案及解析
-
下列实验现象预测正确的是( )
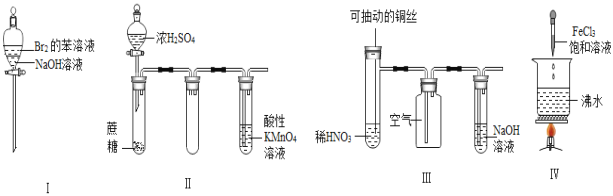
A.实验Ⅰ:振荡后静置,上层溶液颜色保持不变
B.实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验Ⅳ:滴入FeCl3后,可形成带电的胶体,该分散系导电能力增强
难度: 中等查看答案及解析