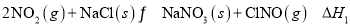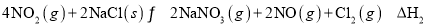-
化学在生活中有着重要的应用。下列叙述错误的是( )
A.燃煤中加入生石灰可以减少酸雨的形成
B.高纯度的二氧化硅广泛用于制作光导纤维
C.花生油中的主要成分属于酯类,是天然高分子化合物
D.碳纳米管表面积大,可用作新型储氢材料
难度: 中等查看答案及解析
-
中华文化源远流长、博大精深。下列有关蕴含的化学知识的说法中,不正确的是( )
A.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
B.“陶尽门前土,屋上无片瓦。十指不沾泥,鳞鳞居大厦。”黏土烧制陶瓷的过程发生了化学变化
C.“兰陵美酒郁金香,玉碗盛来琥珀光。”粮食发酵产生的酒精分散在酒糟中,可以通过蒸馏与酒糟分离
D.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
难度: 简单查看答案及解析
-
下表中相关物质的信息都正确的一项是( )
选项
化学式
电子式或含有的化学键类型
物质的性质
与性质相对应的用途
A
不稳定,易分解
医用消毒剂
B
离子键、共价键
强氧化性
消毒液
C
共价键
水溶液呈弱碱性
工业制硝酸
D
离子键
受热易分解
泡沫灭火器
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
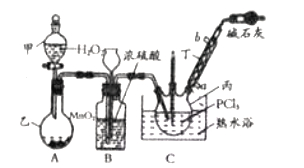
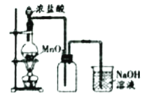
如图所示是实验室常见的气体制取、干燥和收集装置。若用稀盐酸和石灰石制取干燥的CO2,则合理的组合是( )
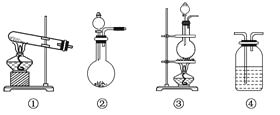
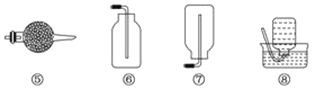
A. ③⑤⑧ B. ③④⑦ C. ②④⑤⑥ D. ②④⑤⑧
难度: 中等查看答案及解析
-
用
表示阿伏加德罗常数的值,下列说法正确的是
A.
的过氧化氢溶液中氧原子数为
B.通过核反应
生成
镆,同时产生中子数为
C.常温常压下,
由
与
组成的混合物中含有的质子总数为
D.
雄黄(
,
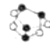 )中含有
)中含有个共价键
难度: 中等查看答案及解析
-
根据下列事实书写的离子方程式正确的是( )
A.用酸性高锰酸钾标准溶液滴定草酸:
B.向
溶液中加入
溶液得到
沉淀:
C.向
溶液中加入足量稀氨水:
D.用铁电极电解饱和食盐水:
难度: 中等查看答案及解析
-
、
、
、
为前20号元素且原子序数依次增大,元素
和
同族。盐
与浓盐酸反应,有黄绿色气体产生,
的焰色反应为浅紫色。下列说法正确的是( )
A.原子半径大小为
B.
简单氢化物的沸点低于
简单氢化物的沸点
C.
与
均含有非极性键
D.标准状况下,单质
与单质
的状态相同
难度: 中等查看答案及解析
-
具有净水作用,但腐蚀设备,工业上常用电浮选凝聚法处理污水。其原理是保持污水的
在
之间,通过电解生成
,沉淀。若阳极同时发生两个电极反应,其中一个反应生成一种无色气体,下列叙述不正确的是( )
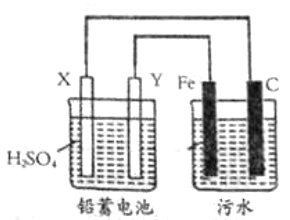
A.
为金属
,
为
B.电解池阳极的一个反应为:
C.污水中生成
的反应为:
D.为增强污水导电能力,加快污水处理效果,可向污水中加入过量的
难度: 中等查看答案及解析
-
由下列实验及现象不能推出相应结论的是( )
实验
现象
结论
A.
向2mL0.1mol/LFeCl3的溶液中加足量铁粉,振荡,加1滴KSCN溶液
黄色逐渐消失,加KSCN溶液颜色不变
还原性:Fe>Fe2+
B.
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C.
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3显碱性
D.
将SO2通入酸性KMnO4溶液
紫色溶液褪色
SO2具有还原性
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
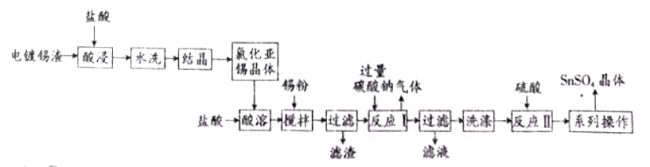
根据如下框图分析,下列说法正确的是( )
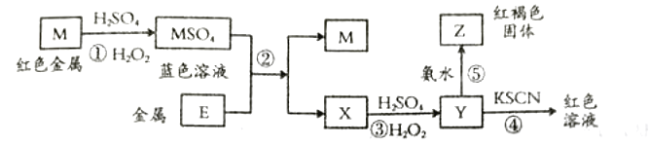
A.
的氧化性比
的氧化性强
B.在反应③中若不加稀硫酸可能看到红褐色沉淀
C.反应⑤的离子方程式可表示为
D.在反应①中只能用浓硫酸,既表现酸性,又表现了氧化性
难度: 简单查看答案及解析
-
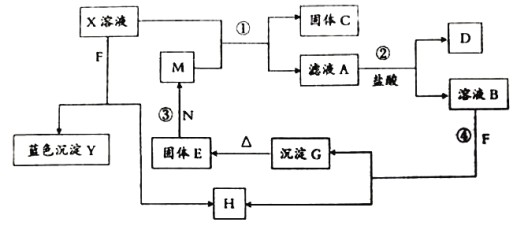
某溶液中含
和
,现向此溶液中滴入
的
溶液,恰好使
、
再滴
溶液,又恰好使
,而
不变此时
,则原溶液中铬元素的质量为( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列实验装置能达到实验目的是( )
选项
A
B
C
D
实验装置
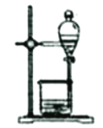
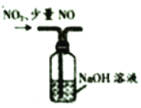
实验目的
用坩埚灼烧除去高锰酸钾中的氯化铵
实验室制备干燥纯净的氯气
分离甘油和水
尾气处理混有少量
的
气体
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.根据反应
,可推出
的还原性比
的强
B.
,每生成
共传移
电子
C.根据反应
可知氧化性:
D.因
的氧化性强于
,所以置换反应
不能发生
难度: 中等查看答案及解析
-
已知反应
,不同温度下,容器中
浓度与反应时间的关系如图所示,下列说法正确的是( )
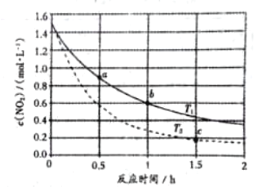
A.
B.
点的正反应速率大于
点的逆反应速率
C.
点的反应速率小于
点的反应速率
D.
点时
的浓度为
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.甲烷的标准燃烧热为
,则甲烷燃烧的热化学方程式可表示为:
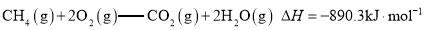
B.已知
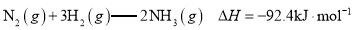 ,则在一定条件下向密闭容器中充入
,则在一定条件下向密闭容器中充入和
充分反应后放出
的热量
C.
石墨转化为
时,放出
的热量
(石墨,
)
D.同温同压下,
在光照和点燃条件下的
不同
难度: 简单查看答案及解析
-
常温下,
,分别向
溶液和
溶液中逐滴加入
溶液,滴定曲线如右图所示,下列叙述正确的是( )
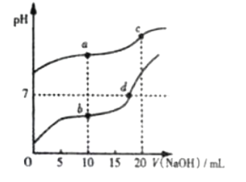
A.
点溶液中存在:
B.
、
点溶液中钠离子浓度的关系为:
C.
点溶液中存在:
D.
点溶液中:
难度: 中等查看答案及解析